Hola chicos, ya que hace mucho que no hago una
entrada, he decidido hacer un breve repaso de todo lo dado hasta ahora de una
forma un poco teórica.
Elementos químicos e
isotopos
Se denominan isótopos a
los átomos de
un mismo elemento, cuyos núcleos tienen una cantidad diferente de neutrones,
y por lo tanto, difieren en masa atómica.
La mayoría de los elementos químicos así como esta poseen más de un isótopo.
Solamente 21 elementos ( berilio, sodio...) poseen un solo
isótopo natural; en contraste, el estaño es
el elemento con más isótopos estables.
Todos los isótopos poseen igual número atómico pero difieren en el número másico.
El numero atómico Z, representa la carga nuclear positiva de sus átomos es decir, el numero de protones que estos contienen en el núcleo.
Un elemento químico se caracteriza por su numero de
protones o numero atómico.
El numero másico A, es el numero de nucleones que contiene su núcleo es decir, la suma de los protones y neutrones que lo forman. Como la masa del neutrón y del protón son parecidas el número másico me indica aproximadamente la masa relativa del átomo.
Los electrones (sobre todo los externos) se pueden ganar o perder. Un átomo neutro tiene el mismo número de electrones que de protones (Z).
Modelo atomico de Bohr
El modelo atómico de
Bohr o de
Bohr-Rutherford es un modelo clásico del átomo, pero fue el primer
modelo atómico en el que se introduce una cuantización a partir de
ciertos postulados. Fue propuesto en 1913 por el físico
danés Niels Bohr, para explicar cómo los electrones pueden
tener órbitas
estables alrededor del núcleo y por
qué los átomos presentaban espectros de emisión característicos (dos problemas
que eran ignorados en el modelo previo de Rutherford). Además el modelo de Bohr
incorporaba ideas tomadas del efecto
fotoeléctrico, explicado por Albert Einstein en1905.
Las ideas de la mecánica cuántica habían borrado las diferencias entre la materia y la energía, entre las partículas y la luz.
Así la energía tenía su equivalente en masa de acuerdo con la fórmula E=m.c2. Podemos crear materia con energía y energía con materia.
Las partículas,los objetos tienen una onda asociada con una longitud de onda (como si fueran luz) :
 donde h es la constante llamada constante de Planck
donde h es la constante llamada constante de Planck
Las ideas de la mecánica cuántica habían borrado las diferencias entre la materia y la energía, entre las partículas y la luz.
Así la energía tenía su equivalente en masa de acuerdo con la fórmula E=m.c2. Podemos crear materia con energía y energía con materia.
Las partículas,los objetos tienen una onda asociada con una longitud de onda (como si fueran luz) :
 donde h es la constante llamada constante de Planck
donde h es la constante llamada constante de PlanckBohr se basó en el átomo de hidrógeno para hacer el modelo que lleva su nombre. Bohr intentaba realizar un modelo atómico capaz de explicar la estabilidad de la materia y los espectros de emisión y absorción discretos que se observan en los gases. Describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón. El modelo atómico de Bohr partía conceptualmente del modelo atómico de Rutherford
Los
principios en los que se basa este modelo son:
-Los electrones describen órbitas circulares en torno
al núcleo del átomo sin radiar energía.
-las orbitas permitidas son aquellas en las que el momento
angular del electron (mvr) es un multiplo de h/2n, donde h es la constante de
Planck.
- El electrón solo emite o absorbe energía en los saltos
de una órbita permitida a otra. En dicho cambio emite o absorbe un fotón cuya
energía es la diferencia de energía entre ambos niveles.
 modelo atómico de
BOHR.
modelo atómico de
BOHR.
Configuración
electrónica
Al referirnos a la configuración
electrónica (o periódica) estamos hablando de la descripción de
la ubicación de los electrones en los distintos niveles (con subniveles y
orbitales) de un determinado átomo.
Científicamente, diremos que es la representación
del modelo atómico de Schrödinger o modelo de la mecánica cuántica.
En esta representación se indican los niveles, subniveles y los orbitales que
ocupan los electronesConfigurar significa "ordenar" o
"acomodar", y electrónico deriva de "electrón"; así,
configuración electrónica es la manera ordenada de repartir los electrones en
los niveles y subniveles de energía.
La solución matemática de la ecuación de
Schrödinger precisa de tres números cuánticos. Cada trío de valores de estos
números describe un orbital.
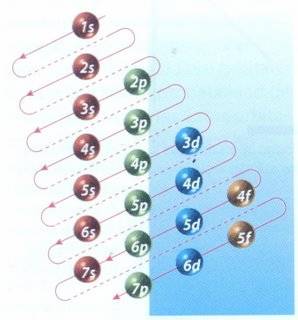
Número cuántico principal (n): puede tomar valores
enteros (1, 2, 3, 4, 5, 6, 7) y coincide con el mismo número cuántico
introducido por Bohr. Está relacionado con la distancia promedio
del electrón al núcleo en un determinado orbital y, por tanto, con el tamaño de
este e indica el nivel de energía.
Número cuántico secundario (l): Los niveles de
energía, identificados con el número cuántico principal (n), poseen
subniveles, los cuales se asocian, además, a la forma del orbital, y
son identificados por el número cuántico secundario (l). Entonces, los
valores del número cuántico secundario dependen del número cuántico
principal "n".
Tres
definiciones muy importantes en estos temas:
. Energía de ionización: La energía
de ionización, potencial de
ionización o EI es
la energía necesaria para separar un electrón en
su estado fundamental de un átomo o
de una molécula
.Afinidad electrónica: La
afinidad eléctrica, afinidad electrónica o AE es la energía intercambiada
cuando un átomo neutro, gaseoso, y en su estado fundamental, capta un electrón
y se convierte en un ión mononegativo
.Electronegatividad: esd la energia de un atomo para atrer
los electrones de otros atomos con los que estan enlazados.
Tipos de
enlaces:


ENLACE
IONICO

ENLACE
COVALENTE

En el enlace covalente se comparten electrones que ocupan orbitales comunes a los dos átomos. Los orbitales atómicos se superponen y pueden dar lugar a:
enlaces pi (enlaces π)
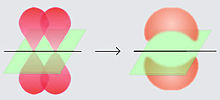
enlace sigma (enlace σ)

Los orbitales atómicos que se superponen son los que proporcionan alguna idea sobre la geometría de la molécula resultante. Esta geometría suele venir dada por los ángulos que formaban los orbitales atómicos y se puede ver modificada ligeramente por la repulsión entre los electrones que forman el enlace (TRPE)
Y para complicar más aún, los átomos a la hora de formar un enlace pueden promocionar electrones a niveles próximos para desaparearlos al máximo y además
ENLACE METÁLICO
(lo tiene que
explicar jose todavía)
Los elementos metálicos se caracterizan por tener unos pocos electrones en la última capa. Pueden perder fácilmente estos electrones, tienen potencial de ionización bajos. Son electropositivos y se intentan transformar en iones positivos o cationes.
Para enlazarse utilizan el enlace metálico. Ocurre así:
a) Los átomos se transforman en iones positivos perdiendo 1, 2 o tres electrones de la última capa.
b) Estos electrones se quedan entre los cationes uniéndoles.
c) Los cationes se aproximan y forman empaquetamientos compactos. Se pueden formar metales puros o bien aleaciones de varios elementos. Los electrones libres que quedan uniendo los cationes proporcionan las principales propiedades de los metales:
Se pueden formar metales puros o bien aleaciones de varios elementos. Los electrones libres que quedan uniendo los cationes proporcionan las principales propiedades de los metales:
a) conducen el calor y la electricidad.
b) son dúctiles y maleables.
c) es un enlace bastante fuerte y por tanto los metales son duros de altos puntos de fusión.
d) si se funden siguen conduciendo la corriente.
Los elementos metálicos se caracterizan por tener unos pocos electrones en la última capa. Pueden perder fácilmente estos electrones, tienen potencial de ionización bajos. Son electropositivos y se intentan transformar en iones positivos o cationes.
Para enlazarse utilizan el enlace metálico. Ocurre así:
a) Los átomos se transforman en iones positivos perdiendo 1, 2 o tres electrones de la última capa.
b) Estos electrones se quedan entre los cationes uniéndoles.
c) Los cationes se aproximan y forman empaquetamientos compactos.
 Se pueden formar metales puros o bien aleaciones de varios elementos. Los electrones libres que quedan uniendo los cationes proporcionan las principales propiedades de los metales:
Se pueden formar metales puros o bien aleaciones de varios elementos. Los electrones libres que quedan uniendo los cationes proporcionan las principales propiedades de los metales:a) conducen el calor y la electricidad.
b) son dúctiles y maleables.
c) es un enlace bastante fuerte y por tanto los metales son duros de altos puntos de fusión.
d) si se funden siguen conduciendo la corriente.
No hay comentarios:
Publicar un comentario