lunes, 27 de octubre de 2014
viernes, 20 de junio de 2014
Excursión
Programa de la excursión:
Los que deseen ir que me envíen un whatsapp

Jueves.
Hace falta saco de dormir, casco
Hace falta saco de dormir, casco
Salida en tren a Reinosa. Estación de Maliaño- Renfe. 9.45h.
Todo el equipaje menos el bocadillo y el bañador (el que quiera bañarse en el río) irá en la furgoneta.
Algunos irán en furgoneta ya que Renfe solo transporta 6 bicis.
En Reinosa compramos cena y desayuno y lo que haga falta.
Hacemos Reinosa-Espinilla por el carril bici
Espinilla-Alto de Palombera- Pista de Barcena. Comemos en ruta
Descanso y baño en el río en Barcena Mayor.
Por la tarde subimos al albergue de los Tojos.
Siempre disponemos de la furgoneta como apoyo.
Nos hacemos la cena y pasamos la noche como queramos.
Viernes.
Nos hacemos el desayuno.
Hacemos un tramo del camino del Emperador. Los Tojos-Viaña.
Comemos.
Llegamos a Cabezón y preparamos la vuelta a casa.

Precio total: 6€ de tren + 6€ de comida
lunes, 2 de junio de 2014
jueves, 29 de mayo de 2014
Septiembre 2005
Cuestiones:
A. ¿Cuanto pesan 20 L de oxígeno gas en CN?
el oxígeno gas es O2. 1 mol pesa 32g p.V=nRT n= 20/22,4= 0,89 moles es decir 28,5 g
¿Cuantos átomos hay? tenemos 0,89 moles de O2 es decir 5,34.10 23 moléculas de O2
en cada molécula hay dos átomos en total 10,68.10 23 átomos de oxígeno
A. ¿Cuanto pesan 20 L de oxígeno gas en CN?
el oxígeno gas es O2. 1 mol pesa 32g p.V=nRT n= 20/22,4= 0,89 moles es decir 28,5 g
¿Cuantos átomos hay? tenemos 0,89 moles de O2 es decir 5,34.10 23 moléculas de O2
en cada molécula hay dos átomos en total 10,68.10 23 átomos de oxígeno
B. Tenemos el átomo A. (No está nada claro el enunciado)
El último electrón tiene de números
cuánticos n=3 l=0. Por tanto su configuración es A: 1s2 2s22p6 3s1. Por tanto es un metal
El átomo
B (3,1)
B: 1s2 2s22p6 3s2 3p3. Por tanto es un no metal
El átomo C (5,1) C: 1s2 2s22p6 3s2 3p6 4s13d104p6
5s2 4d10 5p3 Es un
no metal.
El tipo de enlace del compuesto A-A metálico
B_B enlace covalente
B-C Enlace covalente
A-C Enlace
iónico
C: Número de elementos de los periodos 5º y 6º del sistema
periódico.
Primer periodo. 1s2 2 elementos
Segundo periodo. 2s2
2p6 8 elementos
Tercer periodo. 3s23p6 8 elementos
Cuarto periodo 4s23d104p6 18 elementos
Quinto periodo 5s24d105p6
18 elementos
Sexto periodo 6s2 4f145d106p6
32 elementos hay que acordarse de la forma de la tabla.
D) 2NO(g)
+ O2(g) ↔ 2NO2(g)
ΔH=-114 kJ ΔS=-146J/K
Si aumento el volumen, disminuye la presión, el equilibrio
intenta aumentar la presión con mas moles de gas, es decir a la izquierda.
Si disminuimos la temperatura, el sistema intenta que
aumente yéndose hacia la derecha (exotérmica)
Si introducimos un catalizador el equilibrio no cambia
Para ser espontáneo la variación de energía libre tiene que
ser menor que 0.
ΔG= -114 kJ - T. -146J/K=0
T= 114000/146=
780ºK a esta temperatura su superior es
espontáneo.
E) Disociamos: HClO--- H+
+ ClO-
0,01-x x x
Ka= x.x/(0,01-x) pero x es la
concentración de H+
Por la definición de pH
pH=-log (H+) (H+)=0,0000018 ka=3,16.10-8
Una lejía contiene hipoclorito sódico, cloruro sódico y
agua. ¿Tendrá pH ácido, básico o neutro? Razona la respuesta.
Hipoclorito sódico. Sal de base fuerte y ácido débil, por
hidrolísis da una disolución básica.
El cloruro sódico y el agua son neutros.
La disolución total será básica como corresponde a una lejía.
Opción, Problemas 1.
1.1MnO2 +
KI +
H2SO4↔ MnSO4 + KIO3 + H2O
Reducción 4H+
+ 2e- + MnO2 → Mn+2 + 2 H20 oxidante el MnO2
Oxidación 3 H20 + I- → IO3-1 + 6H+
+ 6e-
3MnO2 +
KI +
3H2SO4↔ 3MnSO4 + KIO3 + 3H2O
3MnO2
pesa 261g KIO3
pesa 211 g si con 261g obtengo 211g
x--------------- 200
x= 247g de oxidante.
1.2 A partir de los datos
Entalpía de formación del CO2 (g) -393 kJ/mol C(s) + O2(g) → CO2
(g)
Entalpía de formación del H2 O (l) -286 kJ/mol H2 (s) + ½ O2(g) → H2
O (l)
Entalpía de formación del CaC2 (s) -59 kJ/mol 2C(s) + Ca(s) → CaC2 (s)
Entalpía de formación del Ca(OH2 ) (s) -986 kJ/mol Ca(s) + O2(g) + H2(g)
→ Ca(OH)2 (s)
Entalpía de combustión del C2H2
(g) -1296 kJ/mol C2H2 (g) + 2,5 O2 → 2CO2 (g) + H2O (l)
Formación del C2H2 (g) 2C(s) + H2(g) → C2H2 (g)
Partimos de la quinta ecuación (quinta * -1) + (primera
*+2) + ( segunda * +1)= 214 KJ/mol
CaC2
(s) + 2H2O (l) → Ca(OH)2
(s) +
C2H2(g)
Esta ecuación es combinación de las siguientes::
(tercera*-1) + (primera*-2) + cuarta + sexta = -320
kj/mol
Si reaccionan 5 g de CaC2, es decir 0,078 moles , en energía se
desprenden 25kJ.
2.12HI (g) ↔ I2(g) + H2
(g)
Inicial 2,56g;0,02moles 0
0
0,02-x x/2 x/2 Kp=0,017 (bastante pequeña)
(0,02-x).0,082.673/0,2
276.(0,02-x) atm 276.x/2 276.x/s
kP= 0,017 = (276.x/2)2 / 276 (0,02-x) x supongo que es mucho más pequeño que
0,2
x=0,0022 moles de acuerdo con la suposición.
Kc = es fácil de calcular como la presión total o los g de
ioduro.
2.2
a) 25mL de HCl 0,1M lo hacemos rreaccionar con 15 mL de KOH 0,2M
tenemos 0,0025 moles de HCl y 0,0030 moles de KOH ... Van a quedar 0,0005 moles de KOH
tenemos un volumen de 40mL.
la concentración de OH- será 0,0005/0,040 = 0,0125 moles/L pOH=-log(0,0125)=1,90 pH=12,1
b) 35 mL de HCl 0,1M con 15 mL de KOH 0,2M
tenemos 0,0035 moles de HCl y 0,0030 moles de KOH ... Van a quedar 0,0005 moles de HCl
tenemos un volumen de 40mL.
la concentración de H+ será 0,0005/0,040 = 0,0125 moles/L pH=-log(0,0125)=1,90
c) volumen necesario de HCl 0,1M para neutralizar 15 mL de KOH 0,2M
tenemos 0,0030 moles de KOH ... necesitamos 0,0030 moles de HCl
si la concentración es 0,1M el volumen será 0,030L o sea 30 mL
d) volumen de HCl 0,1M que se ha de añadir a 15 mL de KOH 0,2M para obtener un pH=12,5
pH=12,5 pOH=1,5 (OH-)=0,0316 mol/L
0,2 . 0,015 - 0,1.V / 0,015+v = 0,0316
2.2
a) 25mL de HCl 0,1M lo hacemos rreaccionar con 15 mL de KOH 0,2M
tenemos 0,0025 moles de HCl y 0,0030 moles de KOH ... Van a quedar 0,0005 moles de KOH
tenemos un volumen de 40mL.
la concentración de OH- será 0,0005/0,040 = 0,0125 moles/L pOH=-log(0,0125)=1,90 pH=12,1
b) 35 mL de HCl 0,1M con 15 mL de KOH 0,2M
tenemos 0,0035 moles de HCl y 0,0030 moles de KOH ... Van a quedar 0,0005 moles de HCl
tenemos un volumen de 40mL.
la concentración de H+ será 0,0005/0,040 = 0,0125 moles/L pH=-log(0,0125)=1,90
c) volumen necesario de HCl 0,1M para neutralizar 15 mL de KOH 0,2M
tenemos 0,0030 moles de KOH ... necesitamos 0,0030 moles de HCl
si la concentración es 0,1M el volumen será 0,030L o sea 30 mL
d) volumen de HCl 0,1M que se ha de añadir a 15 mL de KOH 0,2M para obtener un pH=12,5
pH=12,5 pOH=1,5 (OH-)=0,0316 mol/L
0,2 . 0,015 - 0,1.V / 0,015+v = 0,0316
miércoles, 28 de mayo de 2014
lunes, 12 de mayo de 2014
Apuntes de todo el curso y problemas redox.
APUNTES
Selectividad: Junio 2008 Ejercicio 1.2 Cuestión E Septiembre 2008 Problema 2.2
Selectividad Junio 2005. Cuestión E Ejercicio 2.2 Septiembre 2005 Problema 1.1
Selectividad: Junio 2008 Ejercicio 1.2 Cuestión E Septiembre 2008 Problema 2.2
Selectividad Junio 2005. Cuestión E Ejercicio 2.2 Septiembre 2005 Problema 1.1
sábado, 10 de mayo de 2014
examen redox
1. Indique si las siguientes afirmaciones son
verdaderas o falsas, justificando su respuesta:
a) La reacción redox entre el Sn y el Pb2+ es espontánea.
b) El Sn se oxida espontáneamente en medio ácido. (reacciona con H+)
c) La reducción del Pb2+ con sodio metálico tiene una diferencia de potencial E = 0,125 – 2×(–2,713) = 5,551V
d) La reducción del Sn2+ con sodio metálico tiene una diferencia de potencial E = –0,137 – (–2,713) = 2,576V
Datos. Potenciales normales de reducción (: (Sn2+/Sn) = –0,137;
(Pb2+/Pb) = +0,125; (Na+/Na) = –2,713
2. A 30 mL de una disolución de
CuSO4 0,1 M se le añade polvo de hierro en exceso. Se obtiene Fe2(SO)3
y Cu
a) Escriba y ajuste las
semirreacciones de oxidación y reducción e indique cual es el oxidante.
b) Calcule Eº (diferencia de
potencial) y justifique si la reacción es o no espontánea.
c) Determine la masa de hierro necesaria para llevar a cabo esta
reacción.
Datos. Eº(Cu2+/Cu)= 0,34 V; Eº(Fe3+/Fe)= –0,04 V; Masa atómica relativa
Fe = 56.
3. Se quiere recubrir la superficie
superior de una pieza metálica rectangular con una capa de níquel de 1 g de
masa realizando la electrolisis de una sal de Ni2+
a) Escriba la semirreacción que se produce en el cátodo.
b) Calcule la carga eléctrica que necesito en el proceso.
c) El tiempo que debe transcurrir cuando se aplica una corriente de 3
A.
Datos. F = 96485 C; Masa atómica relativa Ni = 58,7.
4. El dicromato de potasio (K2 Cr2O7) oxida
al yoduro de sodio (NaI) en medio ácido sulfúrico originándose, entre otros,
sulfato de sodio (Na2SO4) , sulfato de cromo (III) (Cr2(SO4)3 y
yodo.
a) Formule las semirreacciones de oxidación y reducción.
b) Ajuste la reacción iónica y diga cuáles son las especies oxidante y
reductora.
c) Ajuste la reacción molecular.
d) Justifique si el dicromato de potasio oxidaría al cloruro de sodio.
Datos. Eº(Cr2O72+ /Cr+3 )
1,33 V; Eº(Cl2/Cl- ) 1,36 V
lunes, 5 de mayo de 2014
ajustes redox

| 1. En el miembro de la reacción donde sobre oxígeno se ponen tantas moléculas de agua como átomos de oxígeno haya en exceso. El exceso de oxígeno e hidrógeno introducido con el agua se compensa añadiendo iones OH- en el miembro contrario. escribir las semireacciones de reducción y oxidación. Ajustar teniendo en cuenta lo anterior. Intentar una reacción en medio ácido y otra en medio básico. |
jueves, 17 de abril de 2014
examen, corrección y notas
En rojo lo que habéis fallado algunos:
1. Se tiene una disolución de ácido acético 5,5.10-2
M. Calcular:
a) El grado de
disociación del ácido acético.
CH3COOH ↔ CH3COO- + H+
5,5.10-2
0 0
5,5.10-2-x x x 1,86.10 -5 = x2/ 5,5.10-2-x
Suponiendo que x es mucho más pequeño que 5,5.10-2
1,86.10 -5
= x2/ 5,5.10-2 x= 1,01.10-3 M es 20 veces más pequeño . No olvidar las unidades.
b) El pH de la
disolución.
pH = -log 1,01.10-3 = 3
c) La molaridad que debería tener una disolución de ácido
clorhídrico para que su pH fuera igual a la disolución anterior de ácido
acético
El ácido clorhídrico se disocia completamente por lo que su
concentración será 1,01.10-3M
Datos: Ka (ácido acético) = 1,86.10 -5
2. Calcular:
a) ¿Cuántos mL de
disolución acuosa 0,10 M de NaOH hay que añadir a 100mL de agua para que su pH sea 12?
La disolución que queremos formar tiene un pH=12 pOH=2
concentración de OH=10-2M
Esta disolución la formamos con un
volumen de 100mL de agua y un volumen V de la primera.
Al tomar un volumen V de la primera
estamos cogiendo 0,1.V moles, por tanto su concentración será:
10-2 = 0,1.V/(0,1+V) 0,001+0,01V=0,1V 0,001=0,09V
V=0,011L
b) ¿Cuántos mL de
disolución acuosa 0,10 M de HCl se necesitan para neutralizar la disolución anterior?
HCl + NaOH → H2O +NaCl
moles de HCl 0,1.V
moles de NaOH 0,01.0,111= 0,0011 moles
para neutralizar según la reacción
tienen que ser iguales 0,1V =
0,0011 V=0,011L
3. Disociar las siguientes sales al disolverlas en agua y
explicar si las disoluciones serán ácidas, básicas o neutras:
a) NaCl
c) NH4Br
.
d) Na2CO3
.
e) CH3COOK
h) Al2 (SO4)3
Constantes de ácidez y basicidad del amoniaco, ácido
carbónico, ácido acético muy bajas.
Está prácticamente bien salvo justificar las uniones con las constantes y algún signo de los iones.
4. Explicar las
teorías de Arrhenius y de Bronsted para los ácidos y bases.
¿Qué es una pareja ácido-base conjugados?
Está prácticamente bien.
5. Mezclamos en 2 L de agua 100
g de ácido acético y 200 g de acetato de sodio.
Indicar aproximadamente la concentración de las principales especies
químicas (moléculas, iones, átomos…) presentes en la disolución.
CH3COONa → CH3COO- + Na+ El acetato de sodio se disuelve
completamente en agua.
Proporciona por tanto 2,44 moles de cada ión es decir una concentración
de 1,22M de ión acetato y catión sodio.
CH3COOH → CH3COO- + H+ El ácido acético se disocia muy poco. Tenemos
una concentración de ácido acético de 1,67/2= 0,835M.
Calcular aproximadamente el pH de la disolución.
CH3COOH → CH3COO- + H+
0,835
0,835-x 1,22+x x
Hay que tener en cuenta que tenemos en el recipient
1,22 de acetate que viene del acetate de sodio y x que vienen del ácido
acético.
Pero x va a ser muy pequeña en cualquier caso
por lo que 0,835-x = 0,835 y
1,22+x=1,22
Aplicando la constante de equilibrio 1,86.10-5
= 1,22 . x /0,835 de donde x = 1,27.10-5M
Por tanto el pH= -log 1,27.10-5 =
-4,9 ligeramente básico
Explicar porqué es una mezcla reguladora del pH.
Si añadimos a la mezcla un ácido los iones H+
se unen al ión acetato (que tenemos mucho) y dan el ácido acético.
Si añadimos una base, los iones OH- de unen a
los H+ que proporciona el ácido (que tenemos mucho) y dan agua.
Ambos iones desaparecen el el pH de la mezcla
se mantiene constante formando una disolución reguladora. El pH se mantiene en
4,9
Ka (ácido acético) = 1,86.10 -5
Na:23 C:12 H:1
O:16
Notas:
Paula 6,5 Aitor: 7,6 Antonio 6,2 Carolina 7,4
lunes, 7 de abril de 2014
Apuntes y exámenes de ácidos y bases.

Aquí tienes unos buenos apuntes resumen de todo el curso.
Examen de ácido y base:
- Teoría de Bronsted-Lowry. Aplícala a las siguientes especies : NH4+ , HSO4- , I- . Escribe las reacciones correspondientes.
- Un ácido débil monoprótico HA tiene una Ka = 3 .10 -6. Si inicialmente tenemos una concentración 0,02 M de HA,
a).- Calcula la concentración de todas las especies en el equilibrio.
b).- Calcula el pH
- Tenemos 100 cm3 de HNO3 0,01 M y añadimos 100 cm3 0,01 M de Ba(OH)2
a) Escribe la reacción
b) Calcula el pH de las disoluciones iniciales
c) Calcula el pH de la disolución final
- Tenemos una disolución de disolución 0,4 M de NH4Cl y se sabe que la Kb (NH3) = 1,8 .10-5.¿Será ácida o básica? Calcular aproximadamente su pH. enlace
- Calcular la Molaridad de una disolución de ácido clorhídrico sabiendo que se necesitan 50 ml de esta disolución para neutralizar 20 gramos de Ca(OH)2 sólido
Datos : Masas atómicas: Cl = 35,5 , H = 1 , Ca= 40 ; O = 16 ;
6. Tenemos 1 Litro de disolución de acido acético 0,5 M . Añadimos 0,8 moles de acetato sódico. Ka del ácido acético 1,9.10-5
a).- Explicar porqué es una disolución reguladora.
b) Calcula su pH
c).- Calcula su pH si añado 2 mL de HCl, 1M
lunes, 31 de marzo de 2014
Hidrólisis de sales.
Disolvemos nitrato amónico en agua:
a) escribir la disociación de la sal.
b)estudiar las posibles interacciones con los iones presentes en el agua.
c)la disolución resultante será ácida o básica.
d) Si disolvemos 100 g de nitrato en 30 L de agua, averiguar el pH si Kb del amoniaco es 1,79.10-5.
Disolvemos 20 g de ácido acético puro (ka = 1,75. 10-5) y 40g de acetato sódico en agua (se disuelve completamente) en 5 L de agua
a)Escribir la disociación de cada sustancia indicando los sentidos del equilibrio.
b) ¿Qué concentración aproximada de cada sustancia tenemos en el equilibrio?
c) ¿Qué sucede si agregamos una sustancia un poco ácida a la mezcla anterior?
d) ¿Qué sucede si agragamos una sustancia un poco básica a la anterior?
a) escribir la disociación de la sal.
b)estudiar las posibles interacciones con los iones presentes en el agua.
c)la disolución resultante será ácida o básica.
d) Si disolvemos 100 g de nitrato en 30 L de agua, averiguar el pH si Kb del amoniaco es 1,79.10-5.
Disolvemos 20 g de ácido acético puro (ka = 1,75. 10-5) y 40g de acetato sódico en agua (se disuelve completamente) en 5 L de agua
a)Escribir la disociación de cada sustancia indicando los sentidos del equilibrio.
b) ¿Qué concentración aproximada de cada sustancia tenemos en el equilibrio?
c) ¿Qué sucede si agregamos una sustancia un poco ácida a la mezcla anterior?
d) ¿Qué sucede si agragamos una sustancia un poco básica a la anterior?
jueves, 13 de marzo de 2014
Examen
1. a) La energía de activación de la siguiente reacción es
134 kJ:
CO (g) +
NO2 (g) CO2 (g) + NO
(g) H = - 340 kJ
Cuando se utiliza un catalizador la energía de activación se
reduce a 104 kJ. Haz un diagrama energético de la reacción en ambos casos,
explicando el efecto de la adición del catalizador e
H para la reacción catalizada. El mismo
Energía de activación de la reacción inversa 474
Ejemplos de catalizadores pueden ser los que tienen los
coches para eliminar gases nocivos, el efecto antioxidante de la vitamina C,
todos los catalizadores (enzimas) biológicos.
2. A 25 °C el producto de solubilidad del yodato de bario es
6’5·10-10. Calcula:
a) La solubilidad de la sal expresada en g/L.
b) La concentración molar de los iones IO3 ¯ y Ba2+ en una
disolución saturada de la sal.
DATOS: Masas atómicas (u): O = 16’0 ; I = 126’9 ; Ba = 137’3
Reacción de disolución del yodato Ba(IO3)2↔ Ba+2
+ 2 IO3-
Si llamamos a s los mol/L que se disuelven s 2s
Utilizando la constante del equilibrio (el producto de
solubilidad) 6’5·10-10 = s .
(2s)2 = 4s3
Despejando s= 0,00055 mol/L
En gramos 0,00055 . 487,1=
0,27 g/L
La cocentración en moles del ión Ba+2 será la
misma 0,00055 mol/L y la del ión iodato será el doble. 0,0011 mol/L
3. Considérese el siguiente sistema en equilibrio:
2 NO (g) ⇄ N2 (g) +
O2 (g) Hº = - 182 kJ
Justifica la veracidad o falsedad de las siguientes
afirmaciones:
a)
La constante de equilibrio, Kc, aumenta al
añadir NO. FALSO
La constante del equilibrio solo depende de
la temperatura. Si aumentamos el NO, la reacción lo consume pero la constante
es la misma.
b)
Kc aumenta con la temperatura. FALSO
La reacción es exotérmica. Al aumentar la
temperatura tiende a disminuirla progresando hacia la izquierda. La constante
del equilibrio disminuye. (disminuye el denominador)
c)
Una disminución de temperatura favorece la
formación de N2(g) y O2(g). VERDAD
La reacción es exotérmica. Al disminuir la
temperatura tiende a aumentarla progresando hacia la derecha y aumentan los
productos.
d)
Si se aumenta la presión total del sistema se
favorece la obtención de NO. FALSOI
Al aumentar la presión la reacción intenta
que disminuya pero no puede hacerlo ya que tenemos los mismos moles. El
Equilibrio no se desplaza.
4. En un matraz de 5 litros se introducen inicialmente 0’2
moles de hidrógeno y 0’2 moles de yodo. Se calienta a 500 °C alcanzándose el
equilibrio siguiente:
H2 (g) + I2 (g) ⇄ 2 HI (g) ,
con una constante Kc = 52
0,2 0,2 0 reaccionan x de hidrógeno
0,2-x
0,2-x 2x
a)
¿Cuáles son las concentraciones de las tres
sustancias en el equilibrio?
Aplico la Kc
52 = (2x/5)2 / ((0,2-x)/5)2
Saco la raíz cuadrada
7,2 = 2x /(0,2-x) 1,44- 7,2x = 2x 1,44=9,2x x=0,157 moles reaccionan.
Concentraciones de hidrógeno y iodo (0,2-0,157)/5= 0,0086 mol/L
Concentración de IH 2.0,157/5 = o,o63 mol/L
b)
¿Cuál es la presión parcial de HI en el
equilibrio? ¿Cuánto vale Kp?
IH Ley de los gases: p.V=nRT p=0,063. 0,082 . 773 = 3,98 atm
I2 y H2 p.V=nRT
p= 0,0086 . 0,082 . 773 = 0,55 atm
Kp = 3,982/(o,55)2
= 52
DATO: R = 0’082 atm·L·K-1·mol-1
Y el problema de Aitor:
1. Cuando se
calienta el pentacloruro de fósforo se disocia según:
PCl5(g) ↔ PCl3(g)
+ Cl2(g)
0,01 0 0 reacciona x
0,01-x x x
A 250ºC , la constante Kc es igual a 209. Un recipiente de 1 L , que contiene inicialmente
0’01 mol de PCl5 se calienta hasta 250ºC . Una vez alcanzado el
equilibrio, calcula:
209 = x2 / 0,01-x 2,09 – 209x = x2 x=0,00999952
a) El grado de
disociación del PCl5 en las condiciones señaladas.
Si de 0,01
reaccionan 0,00999952
De 100 x= 99,9952%
b) Las concentraciones de todas las
especies químicas presentes en el equilibrio.
c) La constante de equilibrio Kp (con
sus unidades)
presión de PCl5(g) p.V = nRT p= (0,01-0,00999952) 0,082 . 523 = 0,000020
atm
presiones de PCl3(g) y Cl2(g)
p.V=nRT p= 0,00999952 . 0,082. 523 =
0,43 atm
Kp = 0,432/0,00002 = 9245 atm
Datos:
R = 0’082 atm·L·/K.mol
2. En un matraz de 1,5 litros en el que se
hizo el vacío se introducen 0,08 moles de N2O4,
calentándose a 35ºC .
Parte del N2O4 se disocia en NO2. Cuando se
alcanza el equilibrio, la presión total es de 2,27 atm.
Calcula: a)
el grado de disociación, b) la presión parcial de dióxido de nitrógeno en
equilibrio, c) el valor de Kc
N2O4,
↔ 2 NO2,
0,08 0 reaccionan x y quedan
0,08-x 2 x
La presión
de cada uno será p.V=nRT
N2O4, p= (0,08-x).0,082. 308 /1,5 = 16,8 (0,08-x)
NO2 p= (2x).0,082. 308 /1,5 = 16,8 (2x) sumando las dos presiones debe dar 2,27 atm
16,8 (0,08-x) + 16,8 2(x) = 2,27
1,34 + 33x = 2,27 x=0,028 moles
reaccionan
Si de 0,08
reaccionan 0,028
De 100 ………………
x x=2,8/0,08 = 35% es el
grado de disociación.
La presión del
dióxido de nitrógeno será : NO2 p= (2x).0,082. 308 /1,5 =16,8 (2x) = 0,91 atm
La
constante del equilibrio será:
Kc= (2x)2
/ (0,08-x) = 0,044
lunes, 10 de marzo de 2014
Ácidos y bases (I)
Apuntes
Soluciones
problemas con soluciones
mas problemas con solución
1. Una disolución de ácido sulfúrico tiene una densidad de 1,2 g/ml y una riqueza del 20 % en peso. a) Calcule su concentración expresada en moles/litro y en gramos/litro. b) Calcule la concentración de protones. c)calcule la concentración de protones de una disolución preparada diluyendo mil veces la anterior. Calcule el pH de esta última disolución. Ö
Soluciones
problemas con soluciones
mas problemas con solución
1. Una disolución de ácido sulfúrico tiene una densidad de 1,2 g/ml y una riqueza del 20 % en peso. a) Calcule su concentración expresada en moles/litro y en gramos/litro. b) Calcule la concentración de protones. c)calcule la concentración de protones de una disolución preparada diluyendo mil veces la anterior. Calcule el pH de esta última disolución. Ö
1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente,
utilizando las ecuaciones químicas necesarias, si las siguientes especies
químicas se comportan como ácidos o como bases: NH3, CH3-COOH, CN-, HCO3- . b) Señale
en cada caso la base o el ácido conjugado. (Cuestión Selectividad. Zaragoza. Junio
1997). ⌦
3.- Indica
cuales son las bases conjugadas de los ácidos así como los equilibrios entre la
forma ácida y la básica: H3O+, HNO2, HCN. ⌦
jueves, 6 de marzo de 2014
para mañana selectividad equilibrio
enlace
cuestión D problema 1.1
enlace
Cuestión B, Problema 1
cuestión D problema 1.1
enlace
Cuestión B, Problema 1
Química por ordenador para convertir el dióxido de carbono en metanol
Un equipo internacional diseña y ensaya un catalizador que facilita y abarata la producción del potencial combustible que, además, se utiliza en la industria de plásticos, pinturas y pegamentos
EL PAÍS Madrid 4 MAR 2014 - 19:36 CET4
Archivado en:
Cada año se producen en el mundo 65 millones de toneladas métricas de metanol, que se utiliza en la fabricación de pinturas, polímeros, pegamentos y disolventes. Además es un combustible potencialmente apto para el transporte, aunque no tan extendido como el etanol. Ahora, un equipo científico internacional ha descubierto un nuevo catalizador que convierte hidrógeno y dióxido de carbono en metanol con menos subproductos que el proceso convencional de fabricación y es potencialmente más limpio y más barato. “Imagínese que pudiera sintetizar metanol utilizando hidrógeno de fuentes renovables (descomponiendo el agua con luz solar, por ejemplo) y dióxido de carbono capturado en las plantas energéticas y otras instalaciones industriales”, comenta Jens Norskov, profesor de ingeniería química de la Universidad de Stanford (EE UU) y uno de los autores del descubrimiento. “También podríamos hacer otros alcoholes, como etanol o propanol que, a diferencia del metanol, se puede añadir ya directamente a la gasolina”, añade.
Los investigadores han dado con el nuevo catalizador, un compuesto de níquel y galio, no por el método tradicional de experimentación en laboratorio, sino que han recurrido al diseño químico por ordenador que permite obtener resultados de compuestos basándose enteramente en cálculos computacionales. Luego, eso sí, han comprobado sus resultados con los clásicos experimentos. Publican los resultados enNature Chemistry.
“El metanol se produce en grandes fábricas a muy altas presiones utilizando hidrógeno, dióxido de carbono y monóxido de carbono de gas natural”, explica el líder de la investigación, Félix Studt, de Laboratorio Nacional de Aceleradores de Stanford (SLAC). “Nosotros estamos buscando materiales que puedan hacer metanol a partir de fuentes limpias a bajas presiones y creando bajas cantidades de monóxido de carbono”. Se trata, en última instancia, de desarrollar todo un proceso industrial a gran escala que no sea contaminante y que resulte neutro de carbono utilizando hidrógeno limpio, señalan los autores en un comunicado de Stanford.
El catalizador utilizado en el proceso habitual de fabricación está hecho de cobre, cinc y aluminio, en un proceso que exige altas presiones. Studt y sus colegas empezaron por estudiar a fondo este catalizador y el proceso, y una vez que lo entendieron a nivel molecular, empezaron a buscar un nuevo catalizador capaz de sintetizar metanol a bajas presiones y utilizando solo hidrógeno y dióxido de carbono. A partir de este punto de la investigación recurrieron al diseño computerizado de materiales. Pudieron así comparar el catalizador de cobre, zinc y aluminio con miles de otros materiales de una gran base de datos de Stanford. El compuesto de níquel-galio resultó ser el candidato más prometedor por sus propiedades.
El paso siguiente era probar lo en laboratorio el nuevo catalizador y para ello, los estadounidenses recurrieron al equipo de Ib Chorkendorff, de laUniversidad Técnica de Dinamarca. Primero sintetizaron el compuesto de níquel y galio en un catalizador sólido y luego comprobaron que efectivamente podía producir metanol a presión ambiente, confirmando que el ordenador había ayudado a hacer la elección correcta. A alta temperatura, el níquel galio produce más metanol que el catalizador convencional de cobre, cinc y aluminio, señalan los expertos de Stanford, y considerablemente menos derivados de monóxido de carbono. Además, añade Chorkendorff, el níquel-galio es un sólido muy estable.
Studt y sus colegas advierten que todavía tienen que mejorar y adaptar el proceso para su aplicación industrial, pero destacan que, de entrada, el níquel es relativamente abundante y que el galio, aunque es más costoso, se utiliza ampliamente en la industria electrónica, lo que sugiere que su uso puede ser idóneo y eficaz en la producción del metanol.
lunes, 17 de febrero de 2014
Solubilidad
Problemas de selectividad 2 opción A y 2 y 5 de opción B
pROBLEMAS DE SELECTIVIDAD. a.1 B.4 Y B.5
TeoríA DE SOLUBILIDAD
viernes, 7 de febrero de 2014
Un examen de química
1. Ejercicios de formulación orgánica.
Descarga este archivo
Realiza los ejercicios 3, 4, 5, 11, 12, 25.
Ejercicios de cinética química. Pulsar en energía de activación o ecuación de velocidad.
Examen de cinética y equilibrio.
Descarga este archivo
Realiza los ejercicios 3, 4, 5, 11, 12, 25.
Ejercicios de cinética química. Pulsar en energía de activación o ecuación de velocidad.
Examen de cinética y equilibrio.
miércoles, 5 de febrero de 2014
lunes, 3 de febrero de 2014
Equilibrio heterogéneo.
Seguimos para este tema la página:
En los rpoblemas anteriores has visto casi exclusivamente sistemas gaseosos en equilibrio, en los que todas las sustancias se encontraban en estado gaseoso a la temperatura de trabajo, como era el caso de la síntesis del amoniaco. 

Si todos los reactivos y productos están en el mismo estado físico, el equilibrio es homogéneo, pero si uno o más reactivos o productos están en una fase diferente, el equilibrio es heterogéneo.
El problema más interesante es el proceso de disolución de una sustancia en agua hasta la saturación. La concentración máxima es la solubilidad y está relacionada con la constante del equilibrio.
Puedes ver esta animación de la disolución de la sal en agua.
Seguimos con los equilibrios en gases:
Septiembre 2012 Selectividad.
Opción 1 : 1 y 3
Opción 2 : 5
Seguimos con los equilibrios en gases:
Septiembre 2012 Selectividad.
Opción 1 : 1 y 3
Opción 2 : 5
jueves, 30 de enero de 2014
Una clase de risa:
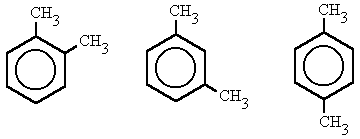
- 1,2-dimetilbenceno, (orto-dimetilbenceno)
- 1,3-dimetilbenceno, (meta-dimetilbenceno)
- 1,4-dimetilbenceno, (para-dimetilbenceno)
Después de los diferentes significados de "orto" y de palabras como ortografía, ortogonal, ortocentro, ortóptero o simplemente orto como lo utilizan en Argentina nos reímos y acabamos diciéndolo mal.
orto-

Prefijo procedente del gr. orthós, derecho, regular, correcto, recto.
quím. Prefijo que designa el ácido más hidratado, o su sal.
quím. org. Prefijo que se emplea para indicar la doble sustitución de los hidrógenos del benceno en la posición 1 y 2.
En resumen el p-dicloro benceno es:
Al elevar la temperatura a la que se realiza una reacción química:
a) Aumenta la velocidad si la reacción es endotérmica, pero disminuye si es
exotérmica.
b) Aumenta siempre la velocidad de reacción.
c) Disminuye la concentración de los reactivos y por ello la constante de
velocidad.
d) Aumenta la velocidad media de las moléculas y con ella la energía de
activación.
La velocidad de una reacción química.
a) Puede expresarse siempre en mol.L-1.s.
b) Puede expresarse siempre en mol.L-1.s-1.
c) Sus unidades dependen del orden de reacción.
Indicar las respuestas verdaderas
Los siguientes datos describen cuatro reacciones químicas del tipo: A + B → C + D:
Energía de activación (kJ∙mol−1) ΔG (kJ∙mol−1) ΔH (kJ∙mol−1)
Reacción I 1 −2 0,2
Reacción II 0,5 5 −0,8
Reacción III 0,7 0,7 0,6
Reacción IV 1,5 −0,5 −0,3
Se desea saber:
a) ¿Cuál es la reacción más rápida?.
b) ¿Cuál o cuáles de estas reacciones son espontáneas?.
c) ¿Cuál es la reacción más endotérmica?.
d) ¿Qué valores de la tabla podrían modificarse por la presencia de un catalizador en
cualquiera de las situaciones anteriores?.
Justifique las respuestas.
El yoduro de hidrógeno se descompone según el equilibrio siguiente:
2 HI (g) ↔ H2 (g) + I2 (g)
Dentro de un recipiente cerrado, en equilibrio, hay 0,38 mol de I2 (g), 0,08 mol de H2 (g) y 1,24 mol de HI (g). Calcula la constante del equilibrio
Se añaden 0,30 mol de H2 (g) y se establece de nuevo el equilibrio.
Calcula el número de moles de cada gas en el equilibrio (que se establece después de la adición de hidrógeno).
Sol: n(HI) = 1,56 mol; n(H2) = n(I2) = 0,22 mol
Suscribirse a:
Entradas (Atom)








