Ahora vamos con las aplicaciones de estas reacciones. Y comenzamos con la fabricación de pilas.
Podemos empezar con este applet.
Las reacciones redox suponen un intercambio de electrones entre las sustancias y por tanto me pueden servir para generar corrientes eléctricas. Para ello tengo que separar las sustancias que ceden electrones de las que los aceptan:
De esta
Zn
+ CuSO4 ↔
Cu + ZnSO4
Zn →Zn+2 + 2e- (oxidación) Cu+2 + 2e- → Cu
(reducción)
Los electrones
que se desprenden en la primera reacción se pueden conducir por un hilo hasta
la segunda.
¿Pero
qué reacción tiene lugar? ¿Quién tiene
más tendencia ceder electrones?
El elemento más oxidante es el Fluor y por tanto es el elemento que tiene más tendencia a coger los electrones de otro elemento (es el elemento que más se reduce). En el extremo opuesto de la tabla está el Francio que será el más reductor.
Para medir la tendencia a ceder o ganar electrones se utiliza una comparación con el hidrógeno.
 De esta manera se elaboran las tablas de potenciales de electrodo para diferentes iones y elementos. Conocemos quién cede electrones y quién los gana como referencia al hidrógeno y por tanto podremos estbalecer comparaciones entre ellos.
De esta manera se elaboran las tablas de potenciales de electrodo para diferentes iones y elementos. Conocemos quién cede electrones y quién los gana como referencia al hidrógeno y por tanto podremos estbalecer comparaciones entre ellos.
Observa en la tabla que el cloro tiene mucha tendencia a ceder electrones mientras que el Litio tiene tendencia a ganarlos.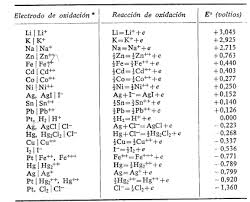

No hay comentarios:
Publicar un comentario