Libro: Páginas 259 y 259.
Esta página con problemas y soluciones del IES Seritium de Jerez de la Frontera (Cádiz)
PROBLEMAS EQUILIBRIOS REDOX
1.- En disolución acuosa y medio ácido del ion permanganato oxida al ion hierro(II) a ion
hierro(III). En este proceso el ion permanganato se reduce a ion manganeso(II).
a) Ajuste la correspondiente ecuación iónica por el método del ion-electrón.
b) Calcule la concentración de una disolución de sulfato de hierro(II) , expresada en mol/l , si 10
ml de esta disolución han consumido 22,3 ml de una disolución de permanganto de potasio de
concentración 0,02 mol/l.
2.- Una pila consta de una semicelda que contiene una barra de platino sumergida en una
disolución 1 M de Fe2+ y 1 M de Fe3+ . La otra semicelda consiste en un electrodo de talio
sumergido en una disolución 1 M de ion talio (I).
a) Escriba las semirreacciones en el cátodo y en el ánodo y la reacción global.
b) Escriba la notación de la pila y calcule el potencial estándar.
DATOS: Potenciales estándar de reducción a 25 °C: Eo (Fe3+/Fe2+) = 0,77V ; Eo (Tl+
/Tl) = -0.34 V .
3.- Escribir las semirreacciones que tienen lugar en el ánodo y en el cátodo, así como la
reacción global en la siguiente pila voltaica: Pt (s)/H2 (g, 1 atm)/H+ (ac, 1 M) || Ag+/Ag (s) .
b) Calcular el potencial global de la misma. DATOS: Eo Ag+/Ag = 0,80 V.
4.- El permanganato potásico, en medio ácido es capaz de oxidar al sulfuro de hidrógeno a
azufre elemental (S) y el permanganato pasa a ion manganeso(II). Ajuste la reacción de
oxidación-reducción, póngala en forma molecular e indique le oxidante, el reductor, la especie
que se oxida y la especie que se reduce.
5.- Indique razonadamente si Ni2+ tiene capacidad para oxidar Cr (0) al estado de Cr3+,
sabiendo que los potenciales normales de reducción, Eo(Ni2+/Ni) y E° (Cr3+/Cr) valen
respectivamente -0.25 y 0,74 V.
Soluciones:
1.-a) Semirreacción de reducción: MnO4- +8 H+ + 5e- --> Mn2+ + 4H2O
Semirreacción de oxidación: Fe2+ --> Fe3+ + 1 e- .
Para igualar el número de electrones intercambiados, se multiplica la segunda semirreacción
por 5, y sumando ambas semirreacciones se obtiene la reacción iónica global:
MnO4- + 8 H+ + 5 Fe2+ --> Mn2+ + 4 H2O + 5 Fe3+
b) N° de moles de KMnO4 = N° de moles de MnO4- = V M = 0,0223 1 0,002 moles/l = 4,46 10-4
moles Como un mol de KMnO4 reacciona con cinco moles de FeSO4, resulta:
N° de moles de FeSO4 = N° de moles de Fe2+ = 5 . 4,46 10-4 moles = 2,23 10-3 moles.
Por tanto, la molaridad de la disolución de FeSO4 es: M =2,23.10-3moles/0,01 l = 0,223 moles/l.
2.- El electrodo que tiene mayor potencial de reducción (más positivo) se reduce, actuando de
polo positivo de la pila (cátodo). El que tiene el menor potencial de reducción (más negativo)
actúa de polo negativo (ánodo) y se oxida, invirtiéndose el proceso en la semirreacción y
cambiando el signo de su potencial de reducción:
Electrodo positivo (cátodo), reducción: Fe3+ + 1 e- = Fe2+ ; Eo = 0,77 V
Electrodo negativo (ánodo), oxidación: Tl = Tl+ + 1 e-; Eo = 0,34 V
Como el número de electrones ya está igualado en ambas semirreacciones, la reacción global
de la pila es la suma de ambas:Fe3+ + Tl = Fe2+ + Tl+
b.- El potencial estándar de la pila es la suma de los potenciales de las semirreacciones:
Eo = 0,77 V + 0,34 V = 1,11 V
Notación de la pila:(-) Tl/Tl+ || Fe3+/Fe2+ (+)
3.- Polo positivo (cátodo), semirreacción de reducción: Ag+ + 1 e- = Ag ; Eo = 0,80 V
Polo negativo (ánodo), semirreacción de oxidación: H2 = 2 H+ +2e- ; Eo= 0 V
b.- El potencial global de la pila se obtiene sumando los potenciales de ambas semirreacciones
(aunque alguna semirreacción se multiplique para igualar los electrones, los potenciales no
varían):
Eo=0,80V+ 0V=0,80V.
4.- Las semirreacciones ajustadas son las siguientes:
MnO4- + 8 H+ + 5e- --> Mn2+ + 4 H2O
S2- --> S + 2e- .
Como el enunciado no especifica qué ácido interviene, supongamos que es ácido sulfúrico. La
reacción en forrna molecular es:
2KMnO4 + 5H2S + 3H2SO4 --> 2MnSO4 + 5S + K2SO4 + 8H20
El oxidante, se reduce, es el perrnanganato potásico ya que capta electrones, el reductor es el
sulfuro de hidrógeno pues cede electrones y, por tanto, se oxida.
5.- Las semirreacciones según el enunciado son las siguientes:
Cr = Cr3+ + 3 e- ; Eo = -0,74 V
Ni2+ + 2 e -= Ni; Eo = -0,25 V
Multiplicando la primera semirreacción por 2 y la segunda por 3, para igualar el número de
electrones, y sumando, resulta:
2 Cr + 3 Ni2+ = 2 Cr3+ + 3 Ni; Eo total = -0,74 + (-0,25) = -0,99 V
Como E° total < 0, esta reacción no es posible. Transcurriría espontáneamente en sentido
contrario.
6.- El etanol se oxida a ácido etanoico. La semirreacción de oxidación es:
CH3 - CH2OH + H2O --> CH3 - COOH + 4 H+ + 4 e - .
El ion Cr2072- se reduce a ion Cr3+, según la semirreacción de reducción siguiente:
Cr2072- + 14 H+ + 6 e - --> 2 Cr3+ + 7 H2O
La ecuación molecular que se obtiene es :
2 K2Cr207 + 3 CH3 - CH2OH + 8 H2SO4 -->2 Cr2(SO4)3 + 3 CH3 - COOH + 2 K2SO4 + 11 H2O
martes, 30 de abril de 2013
viernes, 26 de abril de 2013
Noticias de teatro
Viernes 19: EOI "All is in the timing, guys!"
Martes 23: IES MONTEVIL: "Amor en el parque" Ironika Teatro
Miércoles 24: IES Universidad Laboral: "Mamma Mía"
Jueves 25: IES Universidad Laboral: "Reciclando Lisístrata"
Viernes 26: IES RÍA DEL CARMEN DE CAMARGO (Cantabria) "Tres Sombreros de Copa"

jueves, 25 de abril de 2013
selectividad redox.
2007
1. A partir de los valores de los potenciales normales que vienen en el libro, porqué:
a) El cobre es oxidado por el ácido nítrico y no por el ácido clorhídrico.
b) Los iones Sn (II) y Fe (III) no pueden encontrarse en la misma disolución.
c)El permanganato (MnO4-) no reacciona con las disoluciones que contienen Fe(III)
2. Una reacción frecuente en la valoración de exceso de dicromato potásico presente en una disolución es la siguiente:
2008.
1. Una pila está formada por los elementos Cu/Cu+2 Al/Al+3 que tienen potenciales de reducción estándar de 0,35 V y -1,65V. Haga un esquema de la pila. Señale el sentido en el que circulan los electrones por el exterior y calcule la diferencia de potencial de la pila..
2. El nitrito de sodio (NaNO2) puede reaccionar con el permanganato potásico (KMnO4)) en un medio de ácido sulfúrico según la ecuación no ajustada:
1. A partir de los valores de los potenciales normales que vienen en el libro, porqué:
a) El cobre es oxidado por el ácido nítrico y no por el ácido clorhídrico.
b) Los iones Sn (II) y Fe (III) no pueden encontrarse en la misma disolución.
c)El permanganato (MnO4-) no reacciona con las disoluciones que contienen Fe(III)
2. Una reacción frecuente en la valoración de exceso de dicromato potásico presente en una disolución es la siguiente:
K2CrO7 + H2SO4 + FeSO4 → K2SO4 + Fe2(SO4)3 + Cr2(SO4)3
+ H2O
Se pide:
a) Ajustar por el método del ión electrón, señalando las semireacciones de oxidación y reducción.
b) Un volumen de 10 mL de esa disolución de dicromato reacciona con 20 mL de una disolución de sulfato de hierro (II) que contiene 5 g de sal por L de disolución. Calcular la concentración molar de la disolución de dicromato potásico.
1999
3. Tenemos la reacción:
K2CrO7 + sulfato de hierro (II) + ácido sulfurico ---- sulfato de cromo (III) + sulfato de hierro (III) + ......................................................................................sulfato potásico + agua
a) Ajustar por el método del ión electrón.
b) Una disolución de dicromato potásico contiene 1,73 g/L de cromo ¿Cual es la molaridad de esta disolución?
4. Tenemos la siguiente reacción:
óxido de manganeso (IV) + yoduro potásico + ácido sulfúrico ----- sulfato de manganeso (II) + yodo + sulfato potásico + agua
a) Ajustar por el método de ión electrón.
b) ¿Cuantos gramos de un mineral con un 70% de óxido de manganeso (IV) se necesitan para obtener un gramo de iodo?
2005
5. Ajustar la siguiente reacción por el método de ión electrón:
KMnO4
+ Na2SO3 + H2SO4 →
MnO2 + Na2SO4 + K2SO4 + H2O
¿Cuantos gramos de óxido de manganeso (IV) se obtienen con 1 kg de reductor?
6. Indica razonadamente cuantos elementos hay en el periodo 5 y en el 6 del Sistema Periódico?
1.
2008.
1. Una pila está formada por los elementos Cu/Cu+2 Al/Al+3 que tienen potenciales de reducción estándar de 0,35 V y -1,65V. Haga un esquema de la pila. Señale el sentido en el que circulan los electrones por el exterior y calcule la diferencia de potencial de la pila..
2. El nitrito de sodio (NaNO2) puede reaccionar con el permanganato potásico (KMnO4)) en un medio de ácido sulfúrico según la ecuación no ajustada:
NaNO2 +
KMnO4 + H2SO4 →
MnSO4 + NaNO3 + K2SO4 +H2O
a) ¿Cuantos gramos de nitrito de sodio pueden reaccionar por completo con 100 mL de disolución 0,1M de permanganato potásico? ¿Y cuántos moles de ácido sulfúrico?
b) ¿Cuál es la concentración de ácido sulfúrico, expresada en g/L, que debe utilizarse si son necesarios 20 mL de disolución en la reacción anterior?
3. Para la reacción:
HCl + MnO2 → Cl2 +
MnCl2 + H2O
a) ajustar la reacción usando el método del ión electrón.
b) Calcule el volumen de una disolución de ácido clohídrico de densidad 1,12 g/mL y cuya roqueza es del 36,23% (% en masa) necesario para pbtener 2 L de cloro medidos a 2 atm y 20ºC.
2011.
4. En medio ácido, el ión permanganato MnO4+
se utiliza como agente oxidante fuerte. Contesta razonadamente a las siguientes preguntas y ajusta las reacciones iónicas que se puedan producir, indicando el oxidante y el reductor en cada caso.
a) ¿Reaccionará con el Fe(s)? b) ¿Reaccionará con H2O2?
Datos Eo
(MnO4-/Mn2+)= +1,51 V Eo
(Fe2+/Fe)= -0,44 V Eo
(O2/ H2O2)=
+0,70 V
5. Se ha construido una celda galvánica o pila que consta de un electrodo de Sn sumergido en disolución de Sn+2 (1M) y otro electrodo de Ag sumergido en disolución de Ag+ (1M).
a) Indica el electrodo que actúa como ánodo y el que actúa como cátodo.
b) Escribe las dos semireacciones que tienen lugar en cada electrodo.
c) Dibuja un esquema de la pila dibujando el sentido en que circulan los electrones.
d)Calcula el potencial estandar (diferencia de potencial) de la celda así formada)
Datos Eo
(Sn2+/Sn)= -0,14V Eo
(Ag+/Ag)= +0,80 V
6. Dibuja una pila voltaica construida con electrodos de cobre y plata sumergidos, respectivamente, en disoluciones 1M de sulfato cúprico y nitrato de plata.
a) Indica el ánodo y el cátodo y la circulación de los electrones.
b) Escribe las reacciones de reducción y oxidación y en que electrodo ocurren.
c) Potencial estandar de la pila.
7. Para determinar el hierro que contiene un acero, se disuelve en exceso de HCl una muestra de 0,2886 g de acero, obteniéndose ión Fe2+. este ión se valora en el medio ácido con dicromato potásico (K2Cr2O7) 0,015M para obtener Cr3+ y Fe 3+.
a) Indentifica el reductor y el oxidante en la reacción de valoración.
b)Ajusta la reacción por el método del ión electrón.
c) Si se han utilizado 43 mL de la disolución de dicromato, ¿Cuál es el porcentaje de hierro en el acero?
sábado, 20 de abril de 2013
Pilas eléctricas.
Ya hemos aprendido a igualar reacciones redox por el método del ión-electrón (en medio básico y ácido) y a realizar pequeños calculos de estequiometría en estas reacciones.
Ahora vamos con las aplicaciones de estas reacciones. Y comenzamos con la fabricación de pilas.
Podemos empezar con este applet.
Las reacciones redox suponen un intercambio de electrones entre las sustancias y por tanto me pueden servir para generar corrientes eléctricas. Para ello tengo que separar las sustancias que ceden electrones de las que los aceptan:
 De esta manera se elaboran las tablas de potenciales de electrodo para diferentes iones y elementos. Conocemos quién cede electrones y quién los gana como referencia al hidrógeno y por tanto podremos estbalecer comparaciones entre ellos.
De esta manera se elaboran las tablas de potenciales de electrodo para diferentes iones y elementos. Conocemos quién cede electrones y quién los gana como referencia al hidrógeno y por tanto podremos estbalecer comparaciones entre ellos.
Ahora vamos con las aplicaciones de estas reacciones. Y comenzamos con la fabricación de pilas.
Podemos empezar con este applet.
Las reacciones redox suponen un intercambio de electrones entre las sustancias y por tanto me pueden servir para generar corrientes eléctricas. Para ello tengo que separar las sustancias que ceden electrones de las que los aceptan:
De esta
Zn
+ CuSO4 ↔
Cu + ZnSO4
Zn →Zn+2 + 2e- (oxidación) Cu+2 + 2e- → Cu
(reducción)
Los electrones
que se desprenden en la primera reacción se pueden conducir por un hilo hasta
la segunda.
¿Pero
qué reacción tiene lugar? ¿Quién tiene
más tendencia ceder electrones?
El elemento más oxidante es el Fluor y por tanto es el elemento que tiene más tendencia a coger los electrones de otro elemento (es el elemento que más se reduce). En el extremo opuesto de la tabla está el Francio que será el más reductor.
Para medir la tendencia a ceder o ganar electrones se utiliza una comparación con el hidrógeno.
 De esta manera se elaboran las tablas de potenciales de electrodo para diferentes iones y elementos. Conocemos quién cede electrones y quién los gana como referencia al hidrógeno y por tanto podremos estbalecer comparaciones entre ellos.
De esta manera se elaboran las tablas de potenciales de electrodo para diferentes iones y elementos. Conocemos quién cede electrones y quién los gana como referencia al hidrógeno y por tanto podremos estbalecer comparaciones entre ellos.
Observa en la tabla que el cloro tiene mucha tendencia a ceder electrones mientras que el Litio tiene tendencia a ganarlos.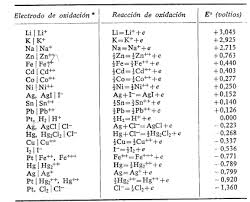
miércoles, 17 de abril de 2013
Reducción-oxidación. Número de oxidación.
.
REDOX.... Reacciones de transferencia de carga eléctrica entre unos átomos y otros.
un elemento se oxida cuando aumenta su carga es decir cede electrones.
un elemento se reduce cuando disminuye su carga es decir absorbe electrones.
un elemento es oxidante cuando oxida a otro es decir cuando absorbe los electrones de otro y se reduce.
Son por ejemplo el propio oxígeno, el ozono, el agua oxigenada, clorato potásico, fluoruro de hidrógeno..

 La oxidación de los metales es un buen ejemplo de este tipo de reacciones. El metal, en este caso, el hierro está sólido y le atribuímos carga 0. El oxígeno del aire esta en forma molecular O2 y también tiene carga 0. Al realizar la reacción: 2Fe+ O2---- 2FeO se forma óxido de hierro. En el óxido de hierro el oxígeno a ganado dos electrones y el hierro ha perdido dos electrones. El hierro se oxida y el oxígeno se reduce. El oxígeno es el oxidante y el hierro el reductor.
La oxidación de los metales es un buen ejemplo de este tipo de reacciones. El metal, en este caso, el hierro está sólido y le atribuímos carga 0. El oxígeno del aire esta en forma molecular O2 y también tiene carga 0. Al realizar la reacción: 2Fe+ O2---- 2FeO se forma óxido de hierro. En el óxido de hierro el oxígeno a ganado dos electrones y el hierro ha perdido dos electrones. El hierro se oxida y el oxígeno se reduce. El oxígeno es el oxidante y el hierro el reductor.
Al final todo se reduce a conocer la carga eléctrica de un elemento. Habría que conocer en profundidad el tipo de enlace. En el iónico, en el metálico o en el covalente apolar no hay problema. En los compuestos polares se atribuye una carga entera en vez de una parte de la carga.
Además podemos recordar las valencias y fórmulas de los aniones y cationes más usuales.
Ejemplo: Página 258. 32 y 33.
Números de oxidación de los elementos en : HCOOH HNO3
SiO44- BO2- KMnO4
Identificar el elemento que se oxida (reductor) y el que se reduce (oxidante):
CO + 2H2 → CH3OH
2H2S
+ SO2 → 3S + 2H2O
El
martes, 16 de abril de 2013
Examen de enlace con soluciones.
1. 1 Considera las siguientes
configuraciones electrónicas:
1ª) 1s2 2s2 2p6 3s1 2ª) 1s2 2s1 2p1 3ª)1s2
2s2 2p5 4ª) 1s2 2s2 2p7
5º) 1s2
2s2 2p6 3s23p6 4s2 3d1
a) Razona cuáles no son posibles.
En los que sean posibles:
b) Deduce los electrones que tienen tendencia a ganar o a perder y el
signo del ión que se formará.
c) Indica si hay alguno que no esté en su
estado fundamental.
d) Indica los números cuánticos posibles
del último electrón.
a) No es posible el 4. No puede haber 7 electrones en el nivel 2p.
b) El primero pierde fácilmente 1 electrón y se transforma en un catión +
El segundo pierde fácilmente 2 electrones y se transforma en un catión +2
El tercero intenta ganar un 1 electrón y se transforma en un anión -1
El quinto puede perder los tres últimos electrones y se transforma en un ión +3 o uno solo +1
c) El elemento 2º tiene un electrón promocionado desde el nivel 2s al 2p
d) En el quinto elemento el último electrón es 3d1
número cuántico principal n=3
número cuántico orbital l= 2
número cuántico magnético m puede ser 2,1,0-1,-2
número cuántico spin s puede ser +-1/2
2, Escribir la estructura electrónica de
los elementos con número atómico 19, 35 y 36; contestar las siguientes
cuestiones justificando cada una de las respuestas:
a) Situar en una tabla periódica cada uno de los
tres elementos indicando el grupo y periodo al que pertenecen.
c) ¿Cuáles son metales y cuáles no
metales?
d) ¿Cuál es el elemento más
electropositivo y cuál el más electronegativo?
e) ¿Cuál será el más grande y cual el más
pequeño?.
19: 1s2 2s22p6 3s23p6 4s1 grupo 4
periodo 1;
35 1s2 2s22p6 3s2 3p6
4s2 3d10 4p5
grupo 4 periodo V (segundo por la derecha)
36 1s2 2s22p6 3s2 3p6
4s2 3d10 4p6
grupo 4 periodo VI gases nobles
El 19 es un metal, el 35
no metal y el 36 gas noble.
El más electropositivo es
el 19, el más electronegativo el 35.
El más pequeño es el 36.
Todos tienen las mismas capas (nivel 4). El 36 tiene 36 protones en el núcleo
que atraen a los electrones y hacen que sea el más pequeño. Por la misma razón el
más grande va a ser el 19.
b) Diseña el ciclo de Born-Haber para el cloruro
de litio y calcula el valor de la afinidad electrónica del cloro, a partir de los siguientes datos:
DATOS: Esub (Li)= 155 kJ/mol ; Edis
(Cl-Cl)= 494 kJ/mol ; Ei (Li)= 520 kJ/mol ;
; Uret (LiCl)=
-2799 kJ/mol ; ∆Hf (LiCl)= -596 kJ/mol
La energía reticular de
un compuesto iónico es la energía que se desprende al formarse 1 mol de
compuesto a partir de los iones.
En nuestro caso Li+ + Cl- →
LiCl(s) U=-2799 kJ/mol
Las energías de las que
tengo datos son:
Esub (Li)=
155 kJ/mol ; Li(s) → Li (g)
Edis (Cl-Cl)= 494 kJ/mol ; Cl2 (g) → 2Cl (g)
Ei
(Li)= 520 kJ/mol ; Li (g) → Li+ (g)
; Uret (LiCl)= -2799 kJ/mol ; Li+
+ Cl- →
LiCl(s) U=-2799 kJ/mol
∆Hf (LiCl)= -596 kJ/mol 1/2Cl2(g) + Li(s) → LiCl (s)
La única reacción que me
falta es la afinidad electrónica Cl(g)→Cl-(g)
pero la puedo obtener
haciendo estas operaciones:
+∆Hf (LiCl)
- Uret (LiCl) - ½ Edis - Esub – Ei =
1278 kJ/mol
4. Dadas las especies químicas BCl3 y
NCl3.
a) Razona la geometría de cada molécula
según el método de Repulsión de Pares de Electrones de la Capa de Valencia, indicando
la hibridación del átomo central.
b) Polaridad de los enlaces B-Cl y N-Cl.
c) polaridad de las moléculas de BCl3 y NCl3
d) Justifica
porqué el NCl3 es líquido a temperatura más alta que el BCl3
B: 5 1s22s22p1 promociona 1 electrón 1s22s12p2
hibrida 1 orbital s y 2 orbitales p 3 orbitales sp2
sitúa los electrones para enlazar en los orbitales
sp2 que tienen una forma triangular plana formando ángulos de 120º
la molécula es plana con
el átomo de Boro en el medio
En el enlace B-Cl, el
cloro tira más de los electrones que el B y por tanto es polar.
En la molécula BCl3
se anulan por simetría los 3 dipolos individuales. La molécula es apolar.
N:7 1s2 2s22p3 utiliza los tres orbitales para enlazar a
los tres cloros. Los orbitales p están dirigidos en las tres direcciones del
espacio. Forman ángulos de 90º. Cuandfo se produce el enlace se sitúan en ellos
los electrones del enlace. Se repelen entre sí y abren un poco la forma
anterior.
El enlace N-Cl es polar.
El cloro tira más de los electrones que el N.
La molécula también es
polar ya que la parte de los cloros es negativa y la parte del n será positiva.
El tricloruro de nitrógeno
será líquido antes ya que sus moléculas polares se atraen más que las del
tricloruro de boro que son apolares.
5. Entre las siguientes sustancias: 1)
sodio, 2) C (diamante), 3) metano CH4
, 4) cloruro de potasio y 5) agua, escoge justificadamente las más representativas de:
a. Una sustancia ligada por fuerzas de
Van der Waals, que funde muy por debajo de la
temperatura ambiente.
b. Una sustancia de alta conductividad
eléctrica, que funde alrededor de los 100°C .
c. Una sustancia covalente de muy alto
punto de fusión.
d. Una sustancia no conductora que se
transforma en conductora el fundir.
e. Una sustancia con enlaces de
hidrógeno.
Na:11
C:6 H:1 K:19
Cl:17
El sodio es un metal por tanto conduce la corriente eléctrica y en este caso se funde a 100 ºC
El diamante es una sustancia covalente. Se forma un cristal con los enlaces sp3 en los vertices de un tetaedro donde hay otro átomo de carbono. Se forma una red cristalina covalente muy unida. Alto punto de fusión.
El metano se forma con una átomo de carbono unido a 4 átomos de hidrógeno. Una molécula apolar que se unirá débilmente a otras moléculas. Será un gas unido por fuerzas de van der waals débiles.
El cloruro de potasio tiene enlace iónico. Una red cristalina de iones positivos y negativos. No conductora pero que conducirá si se funde y se sueltan los iones.
Agua. Enlace covalente entre el H y el O, Una molécula polar que se unirá a otras moléculas polares por enlaces algo fuertes llamados puente de hidrógeno.
6.
Explica mediante el esquema de Lewis (Átomo con puntitos) el enlace
covalente para formar las moléculas de H-H,
F-F, HF y H2O. H:1
F:9 O:8
Estás moléculas se unen entre sí para
formar líquidos o sólidos. Ordena los enlaces entre las moléculas de más
intensidad a menos intensidad
justificando tu afirmación.
¿Cómo se llaman esos enlaces entre las
moléculas?.
H-H covalente apolar. Se unirán débilmente unas moléculas a otras. Son moléculas pequeñas por tanto con débiles fuerzas de van der waals. Será un gas y será necesario enfriar mucho para licuarlo. pf=-259ºC
F-F covalente apolar. Lo mismo que antes. Son moléculas algo más grandes por tanto con fuerzas de van der Waals algo más fuertes. Será un gas pero que se licuará antes que el H2. pf -220ºC
HF covalente polar. estas moléculas estarán unidas por fuerzas de van der waals entre dipolos que son más fuertes que las anteriores. Se licuará a temperaturas más altas -83ºC
H20 covalente polar. Fuerzas intensas entre las moléculas de agua, llamadas puentes de hidrógeno. pf 0ºC
H-H covalente apolar. Se unirán débilmente unas moléculas a otras. Son moléculas pequeñas por tanto con débiles fuerzas de van der waals. Será un gas y será necesario enfriar mucho para licuarlo. pf=-259ºC
F-F covalente apolar. Lo mismo que antes. Son moléculas algo más grandes por tanto con fuerzas de van der Waals algo más fuertes. Será un gas pero que se licuará antes que el H2. pf -220ºC
HF covalente polar. estas moléculas estarán unidas por fuerzas de van der waals entre dipolos que son más fuertes que las anteriores. Se licuará a temperaturas más altas -83ºC
H20 covalente polar. Fuerzas intensas entre las moléculas de agua, llamadas puentes de hidrógeno. pf 0ºC
martes, 9 de abril de 2013
Algunos problemas sobre enlace de selectividad
1. El agua tiene una masa molar de 18g y el butano 58g.
a) Explicar la geometría y polaridad de las dos moléculas.
b) Razonar porqué el agua es líquida a 20ºC y el butano gas.
2. El trifluoruro de Boro y el amoniaco so compuestos gaseosos a 0ºC.
a) explicar la forma y polaridad de estas dos moléculas.
b) ¿Cómo serán los enlaces intermoleculares entre estas dos moléculas?
c) Razonar cual tendrá el punto de ebullición más alto.
3. A, B y C tienen número atómicos 8, 16 y 19
Razonar el tipo de enlace entre elementos A, entre elementos C, entre elementos A y B y entre elementos A y C.
Indicar propiedades de los compuestos que se forman.
4. El tricloruro de Boro es un gas y el tetracloruro de Carbono es un líquido en c.n.
a) Explica la forma y polaridad de estas moléculas.
b) ¿Cómo serán los enlaces intermoleculares en estos compuestos?
c) ¿Por qué uno es líquido y el otro gas?
5. Explica la forma de la molécula de etano, propeno y acetileno.
6. Se tienen las siguientes substancias: agua, cloruro sódico, bromo y sodio. indicar:
a) Substancia en la que hay fuerzas de van der waals (London)
b) Substancia de alta conductividad eléctrica.
c) Substancia no conductora de la corriente eléctrica, pero con buena conductividad en estado fundido.
d) Sustancia con enlaces de puentes de hidrógeno.
H:1 O:8 Na:11 Cl:17 Br:35
7. Definir energía reticular. Relacionar la energía reticular con las otras energías del ciclo de Born-Haber para la formación del NaCl.
Se considera los compuestos iónicos formados por el mismo catión y los aniones de los halógenos F-, Cl-, Br- y I-. A medida que aumenta el número atómico ¿Cómo varía el punto de fusión?
8. Indicar los números cuánticos de los electrones desapareados del átomo Z=16.
Dados los números cuánticos del último electrón que completa la configuración eléctrónica ¿Cómo puede saberse si forman enlace iónico?
9. Con respecto a la molécula de Cl4C indicar razonadamente:
a) hibridación que presenta el átomo de carbono.
b)polaridad de los enlaces y de la molécula.
c) si sera soluble en agua o no
d) de que tipo y como será la fortaleza de los enlaces que forman entre sí moléculas de este compuesto.
a) Explicar la geometría y polaridad de las dos moléculas.
b) Razonar porqué el agua es líquida a 20ºC y el butano gas.
2. El trifluoruro de Boro y el amoniaco so compuestos gaseosos a 0ºC.
a) explicar la forma y polaridad de estas dos moléculas.
b) ¿Cómo serán los enlaces intermoleculares entre estas dos moléculas?
c) Razonar cual tendrá el punto de ebullición más alto.
3. A, B y C tienen número atómicos 8, 16 y 19
Razonar el tipo de enlace entre elementos A, entre elementos C, entre elementos A y B y entre elementos A y C.
Indicar propiedades de los compuestos que se forman.
4. El tricloruro de Boro es un gas y el tetracloruro de Carbono es un líquido en c.n.
a) Explica la forma y polaridad de estas moléculas.
b) ¿Cómo serán los enlaces intermoleculares en estos compuestos?
c) ¿Por qué uno es líquido y el otro gas?
5. Explica la forma de la molécula de etano, propeno y acetileno.
6. Se tienen las siguientes substancias: agua, cloruro sódico, bromo y sodio. indicar:
a) Substancia en la que hay fuerzas de van der waals (London)
b) Substancia de alta conductividad eléctrica.
c) Substancia no conductora de la corriente eléctrica, pero con buena conductividad en estado fundido.
d) Sustancia con enlaces de puentes de hidrógeno.
H:1 O:8 Na:11 Cl:17 Br:35
7. Definir energía reticular. Relacionar la energía reticular con las otras energías del ciclo de Born-Haber para la formación del NaCl.
Se considera los compuestos iónicos formados por el mismo catión y los aniones de los halógenos F-, Cl-, Br- y I-. A medida que aumenta el número atómico ¿Cómo varía el punto de fusión?
8. Indicar los números cuánticos de los electrones desapareados del átomo Z=16.
Dados los números cuánticos del último electrón que completa la configuración eléctrónica ¿Cómo puede saberse si forman enlace iónico?
9. Con respecto a la molécula de Cl4C indicar razonadamente:
a) hibridación que presenta el átomo de carbono.
b)polaridad de los enlaces y de la molécula.
c) si sera soluble en agua o no
d) de que tipo y como será la fortaleza de los enlaces que forman entre sí moléculas de este compuesto.
Suscribirse a:
Comentarios (Atom)
