a) La entalpía del sistema disminuye si en él ocurre una reacción química exotérmica a presión constante.
b) El ΔH de reacción tiene signo menos para las reacciones endotérmicas.
c) La entalpía de los productos es mayor que la de los reactivos en las reacciones exotérmicas.
d) Toda reacción exotérmica libera calor.
2) Al disolver cloruro de calcio en agua cuando el sistema se encuentra aislado del exterior, se observa
que la temperatura de todo el sistema se eleva. La reacción que tiene lugar es:
CaCl2 (s) Ca2+(ac) + 2 Cl-(ac)
¿Cómo será el ΔH de esta reacción, negativo o positivo?. ¿La reacción es exotérmica o endotérmica?
Considere la reacción de hidrogenación del propino: 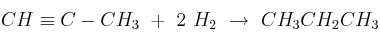
a) Calcule la variación de entalpía de la reacción, a partir de las entalpías medias de enlace.
b) Determine la cantidad de energía que habrá que proporcionar a 100 g de hidrógeno molecular para disociarlo completamente en sus átomos.
Datos: Entalpías de enlace en kJ/mol: (C−C) = 347; (C≡C) = 830; (C−H) = 415; (H−H) = 436.
Masa atómica: H = 1.
No hay comentarios:
Publicar un comentario