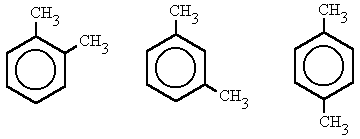
- 1,2-dimetilbenceno, (orto-dimetilbenceno)
- 1,3-dimetilbenceno, (meta-dimetilbenceno)
- 1,4-dimetilbenceno, (para-dimetilbenceno)
Después de los diferentes significados de "orto" y de palabras como ortografía, ortogonal, ortocentro, ortóptero o simplemente orto como lo utilizan en Argentina nos reímos y acabamos diciéndolo mal.
orto-

Prefijo procedente del gr. orthós, derecho, regular, correcto, recto.
quím. Prefijo que designa el ácido más hidratado, o su sal.
quím. org. Prefijo que se emplea para indicar la doble sustitución de los hidrógenos del benceno en la posición 1 y 2.
En resumen el p-dicloro benceno es:
Al elevar la temperatura a la que se realiza una reacción química:
a) Aumenta la velocidad si la reacción es endotérmica, pero disminuye si es
exotérmica.
b) Aumenta siempre la velocidad de reacción.
c) Disminuye la concentración de los reactivos y por ello la constante de
velocidad.
d) Aumenta la velocidad media de las moléculas y con ella la energía de
activación.
La velocidad de una reacción química.
a) Puede expresarse siempre en mol.L-1.s.
b) Puede expresarse siempre en mol.L-1.s-1.
c) Sus unidades dependen del orden de reacción.
Indicar las respuestas verdaderas
Los siguientes datos describen cuatro reacciones químicas del tipo: A + B → C + D:
Energía de activación (kJ∙mol−1) ΔG (kJ∙mol−1) ΔH (kJ∙mol−1)
Reacción I 1 −2 0,2
Reacción II 0,5 5 −0,8
Reacción III 0,7 0,7 0,6
Reacción IV 1,5 −0,5 −0,3
Se desea saber:
a) ¿Cuál es la reacción más rápida?.
b) ¿Cuál o cuáles de estas reacciones son espontáneas?.
c) ¿Cuál es la reacción más endotérmica?.
d) ¿Qué valores de la tabla podrían modificarse por la presencia de un catalizador en
cualquiera de las situaciones anteriores?.
Justifique las respuestas.
El yoduro de hidrógeno se descompone según el equilibrio siguiente:
2 HI (g) ↔ H2 (g) + I2 (g)
Dentro de un recipiente cerrado, en equilibrio, hay 0,38 mol de I2 (g), 0,08 mol de H2 (g) y 1,24 mol de HI (g). Calcula la constante del equilibrio
Se añaden 0,30 mol de H2 (g) y se establece de nuevo el equilibrio.
Calcula el número de moles de cada gas en el equilibrio (que se establece después de la adición de hidrógeno).
Sol: n(HI) = 1,56 mol; n(H2) = n(I2) = 0,22 mol