CLOA (Combinación lineal de orbitales
atómicos)
Otra manera de describir el enlace covalente en términos de
la Mecánica Cuántica consiste en la teoría de los orbitales moleculares (OM).
Según esta teoría, cuando los átomos interaccionan, sus orbitales atómicos
pierden su individualidad y se transforman en orbitales moleculares que son
orbitales que dejan de pertenecer a un solo núcleo para pasar a depender de dos
o más núcleos. El tratamiento matemático que utiliza la Mecánica Cuántica para
el cálculo de los orbitales moleculares es el método de la combinación
lineal de orbitales atómicos, o método CLOA, que considera que el orbital
molecular, es el resultado de la combinación lineal, es decir, una suma o una
resta, de los dos orbitales atómicos implicados.
El caso más sencillo es el de la interacción de dos átomos,
es el de la formación de la molécula de Hidrógeno. Cuando los dos orbitales 1s de dos
átomos de hidrógeno interaccionan se transforman en dos orbitales moleculares Sigma, uno enlazante,
que queda ocupado por los dos electrones, y
otro antienlazante,
que quedará vacío.
El orbital enlazante, es el resultado de la suma de los dos
orbitales atómicos:
La formación del orbital antienlazante, es el resultado de
la otra combinación posible de los dos orbitales atómicos 1s de los
átomos de hidrógeno:

El diagrama de energías relativas de los orbitales
moleculares de la molécula de hidrógeno muestra la situación inicial y final

Tal como se muestra en el esquema, los dos electrones que se sitúan en el orbital molecular
enlazante deben tener espines opuestos (1/2 y -1/2).
La teoría de los orbitales moleculares aplicada a la
molécula de hidrógeno es relativamente sencilla por estar implicados solamente
dos orbitales atómicos y
únicamente dos electrones. Pero en
otras moléculas con más núcleos y varios orbitales atómicos, el tratamiento es
más complicado, pues, para llegar a conocer la situación estable del conjunto
de los átomos de la molécula, habría que considerar orbitales moleculares que
comprendieran a más de dos núcleos o a la molécula entera.
Con Orbitales moleculares s:
El orbital molecular enlazante descrito para la molécula de
hidrógeno, que tiene forma elipsoidal (simétrico respecto al eje de unión de
los dos núcleos), recibe el nombre de orbital molecular σ (sigma).
Por interacción de dos orbitales atómicos de tipo s se forman siempre
orbitales moleculares de tipo σ. Pero a partir de orbitales p (su forma es 8) se
pueden formar orbitales y enlaces σ . Así, cuando un orbital p interacciona
con un orbital s, se llega a
orbitales moleculares σ :

Además de otro antienlazante entre los núcleos de los dos
átomos:

También la interacción frontal de dos
orbitales p
da
origen a dos orbitales moleculares de tipo σ, uno enlazante y otro antienlazante:

Orbitales moleculares p:
A partir de dos orbitales atómicos p puede
originarse otro tipo de orbitales moleculares. El solapamiento entre los dos
orbitales atómicos p puede tener
lugar lateralmente,
para dar lugar a dos orbitales moleculares del tipo (pi), uno
enlazante y otro antienlazante:

Los dos orbitales atómicos p puede orientarse de tal manera que sus
lóbulos del mismo signo, queden al mismo lado reforzándose mutuamente
(situación enlazante) o en lados opuestos (situación antienlazante).

En el orbital enlazante, los dos núcleos de los átomos
quedan unidos por dos zonas p, una superior y otra inferior de distinto
signo. En el orbital antienlazante, las zonas nodales son dos, la del plano que
pasa por los dos núcleos y la de un plano perpendicular al primero que hace que
las zonas superior e inferior queden divididas a su vez en dos partes de
distinto signo:
Probamos a juntar en clase N con N como ejercicio de práctica:

Probamos en clase
otra vez a juntar C con H y al intentar resolverlo como en el ejercicio
anterior vemos que falla el método. Cuando falla hay que recurrir a la teoría
de la hibridación, que suele ocurrir al juntar carbono con otros elementos.
Teoría de la hibridación
La teoría de la hibridación se basa en que los orbitales
atómicos de distinto tipo de un mismo átomo pueden combinarse entre sí para
formar orbitales híbridos de igual energía entre sí, que se sitúen en el
espacio de manera que la repulsión sea mínima, cuando los átomos van a formar
un enlace.
Volviendo al ejercicio anterior, para juntar C con H
recurrimos a la hibridación de orbitales.
C:
1s2 2s2
2p2
1º
Paso Saltar del 2s --> 2p para
que en todas las cajitas haya algún electrón. Simplemente el carbono se excita
con el acercamiento del hidrógeno. Ahora ya tenemos 4 electrones desapareados:
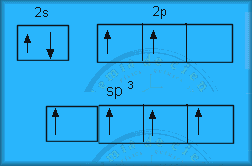
2º Paso Hibridar (mezclar). Hay tres formas de
mezclar:
- 4 orbitales
sp3
Mezclamos 1 orbital s y 3 orbitales p. Se forman 4 orbitales sp3 con forma de tetraedro.

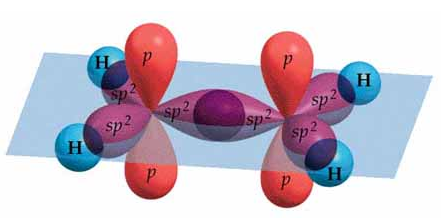
- 3
orbitales sp2
Mezclamos 1 orbital s y 2 orbitales p. Se forman 3 orbitales en un plano, además tenemos un orbital p sin mezclar.
-2 orbitales sp
Mezclamos 1 orbital s y 1 orbital p . Se forman 2 orbitales sp, ademas tenemos 2 orbitales p, sin mezclar:

No hay comentarios:
Publicar un comentario