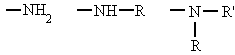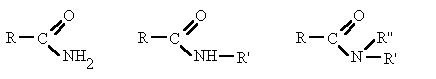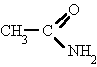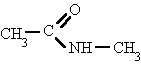1. Explicar razonadamente el número de elementos que tienen los periodos 3º y 4º del sistema periódico.
¿Tienen mayor potencial de ionización los metales o los no metales?
¿Tienen mayor afinidad electrónica los metales o los no metales?
2. Formular:
cloruro amónico
hidróxido de aluminio
etanal
butanona
nitrato de hierro (III)
ácido propanoico
sulfato sódico
amoniaco
2-butanol
2-penteno
ácido etanoico
ácido nítrico
NH4OH
Ca(SO4
PbCl2
CH3COOH
Ch3-CH=CH2
3. Se tienen dos elementos uno de Z=35 y otro cuyos electrones de mayor energía tienen la configuración 4s2.
a)Indicar la posición de cada uno en el sistema periódico y la valencia covalente más probable de cada uno.
b)Cual tiene mayor potencial de ionización.
miércoles, 27 de febrero de 2013
martes, 26 de febrero de 2013
Algunas cuestiones de selectividad
La siguiente fórmula molecular C5H10O2 corresponde a varios isómeros (distintos compuestos) orgánicos.
Escribe la fórmula desarrollada (con los enlaces) de varios compuestos con distintos grupos funcionales que responda a esa fórmula. Nombra esos compuestos.
Escribe la fórmula desarrollada de algún isómero óptico de dichos compuestos.
Dados 3 elementos del sistema periódico A, B, y C de números atómicos 8, 16, y 19 respectivamente:
escribe sus configuraciones electrónicas en el estado fundamental.
Razona que elemento de los tres tendrá su primer potencial de ionización mayor.
Indica y razona el tipo de enlace que se forma con los elementos A y B.
Indica y razona el tipo de enlace que se forma con los elementos A y C.
La siguiente fórmula molecular C4H10O corresponde a varios isómeros (distintos compuestos) orgánicos.
Escribe la fórmula desarrollada (con los enlaces) de 4 compuestos con distintos grupos funcionales que responda a esa fórmula. Nombra esos compuestos.
Escribe la fórmula desarrollada de algún isómero óptico de dichos compuestos.
Escribe la fórmula desarrollada (con los enlaces) de varios compuestos con distintos grupos funcionales que responda a esa fórmula. Nombra esos compuestos.
Escribe la fórmula desarrollada de algún isómero óptico de dichos compuestos.
Dados 3 elementos del sistema periódico A, B, y C de números atómicos 8, 16, y 19 respectivamente:
escribe sus configuraciones electrónicas en el estado fundamental.
Razona que elemento de los tres tendrá su primer potencial de ionización mayor.
Indica y razona el tipo de enlace que se forma con los elementos A y B.
Indica y razona el tipo de enlace que se forma con los elementos A y C.
La siguiente fórmula molecular C4H10O corresponde a varios isómeros (distintos compuestos) orgánicos.
Escribe la fórmula desarrollada (con los enlaces) de 4 compuestos con distintos grupos funcionales que responda a esa fórmula. Nombra esos compuestos.
Escribe la fórmula desarrollada de algún isómero óptico de dichos compuestos.
sábado, 23 de febrero de 2013
Unas cuestiones mal hechas en el examen.
Formular no consiste en saber el nombre de un compuesto, también consiste en tener una idea de como está formada la molécula, que bloques la forman. De esta manera podemos saber como se rompen o disocian.
Por ejemplo decimos que los ácidos sueltan el hidrógeno,o que los hidróxidos sueltan el grupo OH. Las sales nos están indicando en su propio nombre, sulfato de hierro (II), la forma de disociarse en los iones sulfato y hierro(II).
Repaso de formulación:
Compuestos binarios:
Se formulas con IUPACC o Stock. En cualquier caso tenemos que saber la valencia (o enlaces) que forma cada átomo. Estos enlaces son eléctricos y por tanto tenemos que saber que carga eléctrica adquiere cada átomo al formar la molécula, que nos servirá para saber la disociación:
Tenemos que tener a mano una tabla con valencias.
Compuestos ternarios:
Tenemos que saber de memoria los siguientes ácidos:
Por ejemplo decimos que los ácidos sueltan el hidrógeno,o que los hidróxidos sueltan el grupo OH. Las sales nos están indicando en su propio nombre, sulfato de hierro (II), la forma de disociarse en los iones sulfato y hierro(II).
Repaso de formulación:
Compuestos binarios:
Se formulas con IUPACC o Stock. En cualquier caso tenemos que saber la valencia (o enlaces) que forma cada átomo. Estos enlaces son eléctricos y por tanto tenemos que saber que carga eléctrica adquiere cada átomo al formar la molécula, que nos servirá para saber la disociación:
Tenemos que tener a mano una tabla con valencias.

Compuestos ternarios:
Tenemos que saber de memoria los siguientes ácidos:
Nítrico
HNO3 que se disocia en H+ y el ión nitrato NO3- que me servirá para formar sales
Perclórico
HClO4 que se disocia en H+ y el ión perclorato ClNO4- que me servirá para formar sales
Sulfúrico
H2 SO4 que se disocia en 2H+ y el ión sulfato SO4- que me servirá para formar sales
Carbónico
H2 CO3 que se disocia en dos pasos:
a) Primero en H+
y el ión bicarbonato o carbonato ácido HCO3-
b) y después en otro H+
y el ión carbonato CO3-2 que me servirá para formar sales
Fosfórico
H3 PO4 que se disocia en tres pasos:
a) Primero en H+
y el ión dihidrófosfato H2 PO4-
b) Después en otro H+
y el ión hidrófosfato HPO4-2 y por último:
c) Otro H+ y el ión
fosfato PO4-3
Ahora puedo formar
las correspondientes sales:
Fosfato de Cinc Zn3(PO4)2
Carbonato de hierro
(III) Fe2(CO3)3
Sulfato de
sodio Na2SO4
Perclorato de
potasio KClO4
Nitrato de Cobalto (II) Co(NO3)2
Y
jueves, 21 de febrero de 2013
Compuestos orgánicos con nitrógeno
Amidas:

Como siempre con nuestra página de formular ejemplos y problemas.
Aminas:
Como siempre ejemplos y problemas en nuestra página de referencia
Nitrilos:
.
Se pueden considerar compuestos derivados del amoníaco (NH3) al sustituir uno, dos o tres de sus hidrógenos por radicales alquílicos o aromáticos. Según el número de hidrógenos que se sustituyan se denominan aminas primarias, secundarias o terciarias.
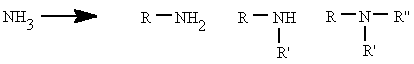 |
Derivan de los ácidos carboxílicos por substitución del grupo -OH por un grupo
dando lugar a amidas sencillas, amidas N-sustituidas o N, N-disustituidas.
| ||||
|
| Se caracterizan por tener el grupo funcional "ciano" -CN, por lo que a veces también se les denomina cianuros de alquilo. | ||
|
martes, 19 de febrero de 2013
Organica 4ª Clase. Ácidos orgánicos. Ésteres. Pag 298
Ácidos orgánicos. Son compuestos oxigenados derivados de los hidrocarburos que se forman al sustituir en un carbono primario dos hidrógenos por un oxigeno que se une al carbono mediante un doble enlace, y el tercer hidrógeno por un grupo (OH) que se une mediante un enlace simple, el grupo formado por esta sustitución, que como hemos dicho se sitúa siempre en un extremo de la cadena y reciben el nombre de carboxilo.
El hidrógeno que está unido al oxígeno se puede ceder y por tanto estamos ante verdaderos ácidos aunque débiles. Ejemplos importantes pueden ser el:
ácido metanoico o ácido fórmico. Responsable del veneno de ciertos insectos (hormigas, abejas, etc)
ácido etanoico o acético. Presente en el vinagre.
ácido butanoico que es responsable del olor de las grasas rancias.
Para conocer más sobre formulación de ácidos la página de siempre.
Ésteres.
Una reacción importante entre compuestos orgánicos es la esterificación. En ella reaccionan un alcohol (-OH) con un ácido (-HCOO). Es una reacción parecida a la de los ácidos y bases inorgánicos. El OH del alcohol se une al H del ácido y da agua; por otro lado se forma un éster.
 ejemplos en la página de siempre.
ejemplos en la página de siempre.
Los aceites vegetales y las grasas animales son esteres derivados de ácidos de cadena larga y del propanotriol (glicerina).

Ésteres.
Una reacción importante entre compuestos orgánicos es la esterificación. En ella reaccionan un alcohol (-OH) con un ácido (-HCOO). Es una reacción parecida a la de los ácidos y bases inorgánicos. El OH del alcohol se une al H del ácido y da agua; por otro lado se forma un éster.
 ejemplos en la página de siempre.
ejemplos en la página de siempre.Los aceites vegetales y las grasas animales son esteres derivados de ácidos de cadena larga y del propanotriol (glicerina).

jueves, 14 de febrero de 2013
Orgánica. Tercera clase.
Vamos a estudiar ahora los compuestos orgánicos con oxígeno.
Podemos encontrar varias familias de compuestos oxigenados: los alcoholes, aldehídos y cetonas, ácidos orgánicos, éteres, ésteres etc.
Vamos a comenzar hoy con los alcoholes. -OH.
Podemos encontrar información y ejercicios pulsando en los enlaces.
Otro ejemplo de alcohol puede ser el 1,2 etanodiol o etilenglicol muy usado como anticongelante: A veces provoca intoxicaciones graves al consumirlo las personas como sustituto del etanol.
A veces provoca intoxicaciones graves al consumirlo las personas como sustituto del etanol.
 A veces provoca intoxicaciones graves al consumirlo las personas como sustituto del etanol.
A veces provoca intoxicaciones graves al consumirlo las personas como sustituto del etanol.
Y seguimos con los aldehídos y cetonas. Tienen el grupo =O.
Ejemplos de aldehídos pueden ser el metanaldehído o formaldehído compuesto extremadamente tóxico y que se puede usar como conservante de seres vivos para que no se pudran.
Otros aldehídos son los responsables de los olores de frutas por lo que usan en perfumería:
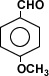 Aquí tenemos el aldehído anísico responsable de los olores anisados.
Aquí tenemos el aldehído anísico responsable de los olores anisados.
Una cetona de uso común es la propanona llamada comercialmente acetona. Muy empleada como disolvente:
miércoles, 13 de febrero de 2013
Orgánica. Segunda clase.
Los enlaces covalentes entre los carbonos y los hidrógenos se pueden romper y volver a formarse conectando nuevos radicales a la molécula original. Normalmente se van a romper aquellos enlaces más débiles uniéndose otros átomos o radicales (bloques de átomos fuertemente unidos)
Así en el metano se puede combinar con el oxígeno: (recordar que el oxígeno dispone de dos enlaces)
O el ácido clorhídrico puede reaccionar con el eteno, rompiendo el doble enlace y uniendo un hidrógeno a un carbono y un cloro al otro:


Unos compuestos orgánicos importantes son los derivados de la familia del cloro (halógenos). Estos elementos funcionan con valencia 1 (1 enlace) y los podemos unir a cualquier compuesto orgánico,
Así se forman los halogenuros.
Y aquí tienes más teoría y ejercicios: Información y ejercicios.
Noticia: En 1988, la Dirección de Educación Ayrshire (AEA) prohibió el uso de Tipp-Ex en todas sus escuelas, el personal y estudiantes por igual. La razón dada era la posibilidad de que el disolvente (1,1,1-tricloroetano) de ser inhalado por los niños como una forma de abuso de sustancias.
Así en el metano se puede combinar con el oxígeno: (recordar que el oxígeno dispone de dos enlaces)
O el ácido clorhídrico puede reaccionar con el eteno, rompiendo el doble enlace y uniendo un hidrógeno a un carbono y un cloro al otro:


Unos compuestos orgánicos importantes son los derivados de la familia del cloro (halógenos). Estos elementos funcionan con valencia 1 (1 enlace) y los podemos unir a cualquier compuesto orgánico,
Así se forman los halogenuros.
Y aquí tienes más teoría y ejercicios: Información y ejercicios.
Noticia: En 1988, la Dirección de Educación Ayrshire (AEA) prohibió el uso de Tipp-Ex en todas sus escuelas, el personal y estudiantes por igual. La razón dada era la posibilidad de que el disolvente (1,1,1-tricloroetano) de ser inhalado por los niños como una forma de abuso de sustancias.
martes, 12 de febrero de 2013
Formulación orgánica 1ªClase
Vamos a aprender a nombrar y dibujar las moléculas de estos compuestos:

Hidrocarburos con enlaces sencillos. Alcanos. Información y ejercicios 1, 2 y 3
Hidrocarburos con dobles enlaces . Alquenos. Información y ejercicios
Hidrocarburos con triples enlaces. Alquinos. Información y ejercicios

Hidrocarburos con enlaces sencillos. Alcanos. Información y ejercicios 1, 2 y 3
Hidrocarburos con dobles enlaces . Alquenos. Información y ejercicios
Hidrocarburos con triples enlaces. Alquinos. Información y ejercicios
Soluciones al examen de ácidos y bases.
Estas son las soluciones del examen. La nota es importante pero sobre todo el examen nos tiene que servir para ver aquellas partes de la lección de ácidos y bases que no controlamos. No vale decir "no se nada", algo sabemos y es importante conocer lo que nos queda por aprender.
Escribo las notas en el blog cuando las tenga.
Mañana comienzo a escribir en el blog un poco de formulación orgánica e inorgánica para que no perdáis el tiempo.
Escribo las notas en el blog cuando las tenga.
Mañana comienzo a escribir en el blog un poco de formulación orgánica e inorgánica para que no perdáis el tiempo.
1. Formamos una disolución A disolviendo 19,60g de H2SO4 en 1600 cm3 de agua. Preparamos
una disolución B añadiendo 45g de KOH a 2L de agua.
a) Averiguar el pH de disolución A y de la
disolución B.
b) Queremos neutralizar la disolución A
añadiendo poco a poco la disolución B. ¿Qué volumen de disolución B necesito
para neutralizar la disolución A?
Disolución A H2SO4 -------
2H+ + SO4= podemos escribirla con el agua o sin ella.
Ácido fuerte
Si disuelvo 19,60g, 19,60/98=0,2
moles Tendré 0,4 moles de H+ concentración
0,4/1,6=0,25 mol/L
Luego el pH=-log(H+) = 0,6
muy ácido.
Disolución B KOH ----- K+
+ OH- base fuerte
Si disuelvo 45 g, 45/56,1= 0,82
moles Tendré 0,82 moles de OH- concentración 0,82/2=0,41 mol/
Para calcular el pH primero calculo la concentración de H+. (H+).(OH-)=10-14 (H+)= 10-14/0,41=
2,44.10-14
Luego el pH= 13,6 muy básico
Reacción de
neutralización: H2SO4 + 2KOH → 2H2O + K2SO4
En la
disolución A tengo 0,2 moles de ácido. De la disolución B necesito 0,4 moles de
base.
Como la
concentración de B es 0,41 moles/L
. Proporción 0,41 moles… 1L
0,4 moles …. X x=0,97L
de disolución B
2. Teniendo en cuenta que el ácido fluorhídrico
es un ácido débil (Ka= 6,3.10-4) calcular en qué volumen de agua hay
que disolver 4 g de ácido para obtener un pH=2,1.
¿Cuál
sería el grado de disociación del ácido?
Reacción de disociación: HF ↔
H+ + F- ácido débil
Nos dan
el pH=2,1, por tanto sé la concentración de H+ 0,0079 mol/L
La concentración inicial del ácido (antes
de disociar) no la conozco y la voy a llamar c.
|
Inicial
|
C
|
0
|
0
|
|
Equilibro
|
c-x=c-0079
|
X=0,0079
|
X=0,0079
|
Constante de equilibro 6,3.10-4 =
(0,0079).(0,079)/(c-0,0079)
Voy a suponer que c es mucho mayor que
0,0079 6,3.10-4 =
0,000063/c c= 0,1 (como habíamos supuesto)
La concentración inicial de ácido es 0,1
mol/L = (4/20)/V V=2L
El grado de disociación con una proporción:
Si 0,1 se han disociado 0,0079
De 100 se
disocian x x= 100. 0,0079/0,1=
7,9%.
3. Escribir las fórmulas de las siguientes especies químicas y como
se disocian al disolverlas en agua:
Hidróxido de Calcio. Ca(OH)2 se disocia en Ca+2 y
2(OH)-
Ácido carbónico: H2CO3 se disocia primero en H+ y HCO3- (ácido débil)
Sulfato de Cinc: ZnSO4 se disocia en Zn+2 SO4-2
Clorato de Sodio: NaClO3 se disocia en Na+ y ClO3-
Cloruro de hierro (II): FeCl2 se disocia en Fe+2 y 2Cl-
Nitrato amónico: NH4NO3 se disocia en NH4+ y NO3-
4. Disolvemos en agua las siguientes sales: Ca(SO4) y NH4ClO4
¿Qué
ocurrirá en cada caso?
Ca(SO4) se disocia en Ca+2 y SO4-2 ,
estos iones intentan reaccionar con los iones presentes en el agua:
Ca+2 + 2 OH- ---
Ca(OH)2 pero esta reacción no ocurre. El
hidróxido de calcio es una base fuerte y
la reacción predominante es hacia la izquierda.
SO4-2 + 2H+ ----
H2SO4 esta reacción tampoco ocurre. El ácido
sulfúrico es un ácido fuerte y la reacción es hacia la izquierda.
Los iones que vienen de la sal no
reaccionan con el agua. No hay
hidrólisis. El agua sigue neutra.
NH4ClO4 se disocia en NH4+ y ClO4- estos iones intentan reaccionar con los iones
presentes en el agua:
NH4+ + OH-
---- NH3 + H2O está desplazada hacia la derecha ya que el
amoníaco es una base débil
ClO4- + H+ --- HClO4 está desplazada hacia la izquierda ya que el
ácido perclórico es fuerte
Hay
hidrólisis. Han desaparecido iones OH-, la disolución será ácida.
5.
En 1 L de
agua disolvemos 100 g de acetato de sodio
y 100 g de ácido acético:
¿Qué iones y en qué cantidad tendré en la
disolución?
NaCH3COO ----- Na+ + CH3COO- por este lado tendré una disociación total.
100g= 1,22 moles 1,22 moles de Na+ y 1,22 moles de acetato.
HCH3COO ---- H+ + CH3COO- el ácido acético es un ácido débil
100g=1,67 moles tendré prácticamente 1,67 moles de ácido y
una muy pequeña cantidad de H+
Calcular aproximadamente el pH de la disolución
Si la constante del ácido es Ka
Ka= (H+ ).( CH3COO- )/ (HCH3COO ) despejando
(H+ ). = Ka. (HCH3COO
)/ (CH3COO- ) y
aproximadamente = Ka . 1,67/1,22= 1,36 Ka
¿Qué ocurrirá si agregamos a la disolución
un ácido?
Al agregar
protones, estos reaccionan con los abundantes iones acetato para producir ácido
acético. Por tanto el pH de la disolución no cambia.
¿Qué ocurrirá si agregamos a la disolución
una base?
Si
agregamos pequeñas cantidades de base, esta reacciona con los iones H*
de la disolución y la reacción HCH3COO ---- H+ + CH3COO- se desplaza hacia la izquierda (ley de Le
chatelier) para oponerse a esa disolución.
También se producen algunos iones acetato pero en comparación a los que
tenemos esto no es importante. La
disolución no cambia tampoco el pH
Tenemos
una disolución reguladora
jueves, 7 de febrero de 2013
Clase del jueves. DR.
Hola químicos, ya hace un poco que no escribía aquí, pero no he tenido ordenador en todo este tiempo debido a un virus... Pero ya estoy aquí.
Hoy en clase de química hemos empezado diciendo la teoría que entra en el exámen de mañana...
-Teoría de Arrhenius: Un ácido es toda sustancia que en disolución acuosa se disocia con formación de iones hidrógeno(protones), H+.
Una base es toda sustancia que en disolución acuosa se disocia con formación de iones hidroxilo, OH-.
-Teoría de Brönsted-Lowry: Un ácido es toda especia química , molecular o iónica, capaz de ceder un iónn H+, es decir un protón, a otra sustancia.
Una base es topda especie química, molecular o iónica, capaz de recibir un ión H+ de otra sustancia.
-Indicadores: Es una sustancia de carácter ácido o básico débil que tiene la propiedad de presentar colores diferentes dependiendo del pH de la disolución en que se encuentra disuelto.
-Disolución reguladora: Es aquella disolución que es capaz de mentener su pH prácticamente constante aunque se les añadan pequeñas cantidades de un ácido o de una base o cuando se diluye.
-Hidrólisis: La hidrólisis de una sal es la reacción ácido-base que pueden realizar los iones de la sal con el agua.
Después Ana O. nos ha explicado la teoría de la disolución reguladora para que por fín lo entendiésemos todos o algunos por lo menos.. "Formación de una disolución reguladora: Ácido débil + sal de su base conjugada."
Y para acabar la clase hemos hecho dos problemas de neutralización, uno fácil y otro más complicado, que como entre mañana en el examen ya podemos confesarnos... :'3
Eso ha sido todo por hoy, y ya volveré a escribir a diario, que ya tengo ordenador.. ay..
Mañana exámen, preparáoslo bien, espero muchos soresalientes e.e "que la suerte esté siempre de vuestra parte."
Sed buenos.
Hoy en clase de química hemos empezado diciendo la teoría que entra en el exámen de mañana...
-Teoría de Arrhenius: Un ácido es toda sustancia que en disolución acuosa se disocia con formación de iones hidrógeno(protones), H+.
Una base es toda sustancia que en disolución acuosa se disocia con formación de iones hidroxilo, OH-.
-Teoría de Brönsted-Lowry: Un ácido es toda especia química , molecular o iónica, capaz de ceder un iónn H+, es decir un protón, a otra sustancia.
Una base es topda especie química, molecular o iónica, capaz de recibir un ión H+ de otra sustancia.
-Indicadores: Es una sustancia de carácter ácido o básico débil que tiene la propiedad de presentar colores diferentes dependiendo del pH de la disolución en que se encuentra disuelto.
-Disolución reguladora: Es aquella disolución que es capaz de mentener su pH prácticamente constante aunque se les añadan pequeñas cantidades de un ácido o de una base o cuando se diluye.
-Hidrólisis: La hidrólisis de una sal es la reacción ácido-base que pueden realizar los iones de la sal con el agua.
Después Ana O. nos ha explicado la teoría de la disolución reguladora para que por fín lo entendiésemos todos o algunos por lo menos.. "Formación de una disolución reguladora: Ácido débil + sal de su base conjugada."
Y para acabar la clase hemos hecho dos problemas de neutralización, uno fácil y otro más complicado, que como entre mañana en el examen ya podemos confesarnos... :'3
Eso ha sido todo por hoy, y ya volveré a escribir a diario, que ya tengo ordenador.. ay..
Mañana exámen, preparáoslo bien, espero muchos soresalientes e.e "que la suerte esté siempre de vuestra parte."
Sed buenos.
miércoles, 6 de febrero de 2013
Examen de química.
escribimos en Google "examen de ácidos y bases 2º de bachillerato"
Examen de Jose Vicente Instituto Albarregas de Mérida
Examen de Jose Vicente Instituto Albarregas de Mérida
Suscribirse a:
Entradas (Atom)